Exercícios sobre calorímetro e as trocas de calor
(FIEB-SP) O copo interno de um calorímetro é feito de alumínio e tem massa de 30 g. Em seu interior, onde há 150 g de água pura à temperatura de 20 ºC, são despejados 200 g de bolinhas de aço que se encontram inicialmente à temperatura de 60 ºC. Sabendo que o calor específico do alumínio é 0,2 cal/g.ºC, o da água, 1 cal/g.ºC, e a temperatura de equilíbrio térmico do conjunto igual a 25 ºC, o calor específico do aço e a quantidade de calor trocada pelas bolinhas de aço com o sistema têm valores, respectivos e aproximadamente, iguais a
a) 0,11 cal/g.ºC e 780 cal, cedidas.
b) 0,11 cal/g.ºC e 780 cal, recebidas.
c) 0,55 cal/g.ºC e 890 cal, cedidas.
d) 0,55 cal/g.ºC e 890 cal, recebidas.
e) 0,88 cal/g.ºC e 780 cal, cedidas.
Letra A.
A soma das quantidades de calor trocadas no calorímetro é nula. Sendo assim, podemos escrever:
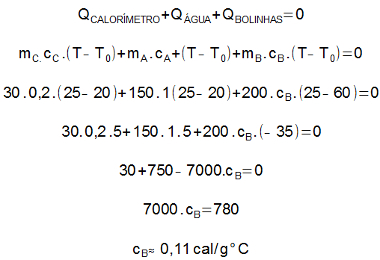
Como houve diminuição da temperatura das bolinhas de aço, elas cederam calor para o sistema.

(UEA-AM) Define-se a capacidade térmica de um corpo (C) como a razão entre a quantidade de calor que ele recebe (Q) e a correspondente variação de temperatura ocorrida (ΔT):
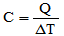
Se um corpo de capacidade térmica 25 cal/ºC recebe calor de uma fonte durante 20 minutos com taxa constante de 50 cal/min, ele sofre uma variação de temperatura, em ºC, igual a
a) 10,0.
b) 40,0.
c) 50,0.
d) 62,5.
e) 84,5.
Letra B.
Se o corpo recebe 50 cal por minuto de uma fonte térmica qualquer, em 20 min, a quantidade de calor recebida terá sido de 1000 cal.
20 min . 50 cal/min = 1000 cal.
Assim, a partir da equação que define a capacidade térmica, pode-se determinar a variação de temperatura sofrida pelo corpo.
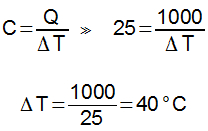
Em um calorímetro de capacidade térmica desprezível, foram misturados 200 g de água, inicialmente a 20 °C, e 400 g de ouro, inicialmente a 80°C. Sabendo que os calores específicos da água e do ouro são, respectivamente, 1 cal/g°C e 0,03 cal/g°C. Determine a temperatura final aproximada da mistura.
a) 24°C
b) 20°C
c) 30°C
d) 38°C
e) 36°C
Letra A.
A soma das quantidades de calor trocadas no calorímetro é nula. Sendo assim, podemos escrever:

A respeito das grandezas e equações da calorimetria, marque o que for correto.
a) A unidade de medida da capacidade térmica, de acordo com o Sistema Internacional de Unidades (SI), é J/°C.
b) O calor específico é a quantidade de calor necessária para que 100 g de uma substância qualquer sofra variação de 1 °C.
c) A unidade de medida do calor específico, de acordo com o Sistema Internacional de Unidades (SI), é cal.g/°C
d) A quantidade de calor latente nunca será levada em consideração na análise das trocas de calor para elementos em um calorímetro.
e) O calorímetro impede as trocas de calor com o meio externo e proporciona o estudo das trocas de calor apenas dos objetos que são estudados.
Letra E.
a) Errada. A unidade de medida da capacidade térmica, de acordo com o Sistema Internacional de Unidades (SI), é o J/K.
b) Errada. O calor específico é a quantidade de calor necessária para que 1 g de uma substância qualquer sofra variação de 1 °C.
c) Errada. A unidade de medida do calor específico, de acordo com o Sistema Internacional de Unidades (SI), é J/kg.K
d) Errada. Tanto calor sensível quanto calor latente são considerados em cálculos envolvendo calorímetros.
e) Correta.






