Exercícios sobre cálculo da constante de equilíbrio Kc
(UFPB) Se 1 mol de H2(g) e 1 mol de I2(g), em um recipiente de 1 litro, atingirem a condição de equilíbrio a 500 ºC, a concentração de HI no equilíbrio será:
Dado: Kc = 49.
a) 2,31.
b) 5,42.
c) 1,56.
d) 3,29.
e) 4,32.
Alternativa “c”.
Temos:
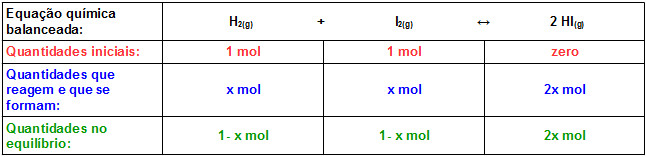
Considerando que o volume é de 1 L e que Kc = 49, vamos usar a expressão da constante de equilíbrio Kc para descobrir a concentração de HI:
Kc = [HI]2
[H2] . [I2]
49 = (2x)2
(1-x) . (1-x)
49 = 4x2
1 – 2x + x2
45x2 – 98x + 49 = 0
Visto que temos uma equação de 2º grau aqui, teremos que usar a fórmula de Bhaskara para resolver:
-Fórmula geral das equações de 2º grau: ax2 + bx + c = 0;
- Fórmula de Bhaskara:
x = -b ± √b2 – 4 . a . c
2 . a
x = -(-98) ± √(-98)2 – 4 . 45 . 49
2 . 45
x = 98 ± √784
2 . 45
x = 98 ± √784
90
x1 = +1,4 > 1,0 mol (não tem significado físico)
x2 = 0,78
Agora descobrimos a concentração de HI:
[HI] = 2 x = 2 . 0,78 = 1,56 mol/L
(PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está representado pela equação:
2SO2(g) + O2(g) ↔ 2SO3(g)
Em um recipiente de 1 litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de oxigênio. Depois de algum tempo, o sistema atingiu o equilíbrio; o número de mols de trióxido de enxofre medido foi 4. O valor aproximado da constante de equilíbrio é:
a) 0,53
b) 0,66
c) 0,75
d) 1,33
e) 2,33
Alternativa “d”.
Temos:
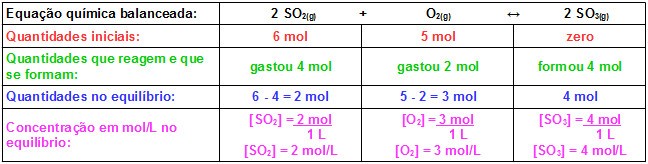
Agora basta substituir os valores encontrados na expressão da constante de equilíbrio Kc dessa reação:
Kc = [SO3]2
[SO2]2 . [O2]
Kc = __(4)2__
(2)2 . 3
Kc = 1,33
Em um recipiente de 5 L, a uma temperatura T, são misturados 5 mol de CO(g) e 5 mol de H2O(g). Quando o equilíbrio é atingido, coexistem 3,325 mol de CO2(g) e 3,325 mol de H2(g). Calcule o valor de Kc, na temperatura T, para o seguinte equilíbrio:
CO(g) + H2O(g) ↔ CO2(g) + H2(g)
a) 3940
b) 394
c) 0,394
d) 39,4
e) 3,94
Alternativa “e”.
Temos:
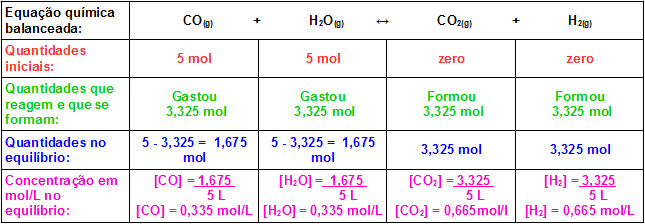
Agora basta substituir os valores encontrados na expressão da constante de equilíbrio Kc dessa reação:
Kc = ___[CO2] . [H2]___
[CO] . [H2O]
Kc = 0,665 . 0,665
0,335 . 0,335
Kc = 0,442225
0,112225
Kc = 3,94
Analise o diagrama a seguir que mostra as variações de concentração em mol/L de NO2 e N2O4 até atingirem o equilíbrio, dado pela reação 2 NO2 ↔ N2O4.
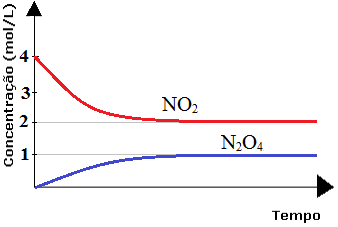
Diagrama de reação em equilíbrio químico
Determine a alternativa que indica o valor correto de Kc nessas condições:
a) 0,25
b) 0,5
c) 2,5
d) 2
e) 4
Alternativa “a”.
Visto que o diagrama já nos fornece as concentrações no equilíbrio, a tabela pode ser dispensada e já substituímos os valores na expressão da constante de equilíbrio Kc:
2 NO2 ↔ N2O4.
Kc = [N2O4]
[NO2]2
Kc = 1
22
Kc = 1
4
Kc = 0,25






