Exercícios sobre a Lei de Lavoisier
O cálcio reage com o oxigênio produzindo o óxido de cálcio, mais conhecido como cal virgem. Foram realizados dois experimentos, cujos dados estão alistados na tabela a seguir de forma incompleta:

Descubra os valores de x, y e z com o auxílio das Leis de Lavoisier (Lei de Conservação das Massas) e de Proust (Lei das Proporções Constantes).
A lei de Lavoisier diz que a massa no sistema permanece constante, portanto, temos:
40 g + x = 56 g
x = (56 -40) g
x = 16 g
A Lei de Proust diz que a proporção se mantém constante, então se a massa do oxigênio era 16 g e passou para 32 g, isso significa que ela dobrou. Assim, todos os outros valores também dobraram:
y =40 g . 2 = 80 g
z = 56 g . 2 = 112 g
100 g de calcário é colocada sob aquecimento e se decompõe em 56 g de cal viva e 44 g de gás carbônico. Essa afirmativa está baseada na lei de qual cientista?
a) Lavoisier
b) Dalton
c) Richter
d) Gay-Lussac
e) Proust
Alternativa“a”. Porque a Lei de Lavoisier é a Lei da Conservação das Massas, que diz que a massa total dos produtos é igual à massa total dos reagentes. Veja que o reagente tinha 100 g e os produtos também, pois 56 + 44 = 100.
Na reação de neutralização do ácido clorídrico pelo hidróxido de magnésio, sabe-se que 73 g do ácido reage com 58 g do hidróxido com formação de 36 g de água. Baseado nessas informações e utilizando a Lei de Lavoisier, determine a massa do outro produto dessa reação, o cloreto de magnésio.
A massa formada de cloreto de magnésio é de 95 g, pois:
ácido clorídrico + hidróxido de magnésio → cloreto de magnésio + água
73 g 58 g x 36g
Pela Lei de Lavoisier, temos que a massa total dos produtos é igual à massa total dos reagentes. Desse modo, temos:
73 + 58 = x + 36
x = 95 g
(Fuvest-SP) Os pratos A e B de uma balança foram equilibrados com um pedaço de papel em cada prato e efetuou-se a combustão apenas do material contido no prato A. Esse procedimento foi repetido com palha de aço em lugar de papel. Após cada combustão, observou-se:

Com papel Com palha de aço
a) A e B no mesmo nível A e B no mesmo nível
b) A abaixo de B A abaixo de B
c) A acima de B A acima de B
d) A acima de B A abaixo de B
e) A abaixo de B A e B no mesmo nível
Alternativa “d”. Quando o papel é queimado, forma-se gás carbônico e vapor de água que abandonam o sistema (que é aberto), fazendo com que o prato A fique mais leve que o prato B (A acima de B). Já no caso de queimarmos a palha de aço, formam-se óxidos de ferro que permanecem no sistema, fazendo com que o prato B fique mais pesado do que o A (A abaixo de B).
(FUVEST/SP)O conjunto esquematizado contém inicialmente os reagentes A e B separados. Utilizando dois conjuntos desse tipo, são realizados os experimentos 1 e 2, misturando-se A e B, conforme descrito a seguir:
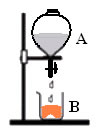
Experimento 1:
Reagente A: solução aquosa de nitrato de prata.
Reagente B: pó de cloreto de sódio.
Produtos: cloreto de prata sólido e solução aquosa de nitrato de sódio.
Experimento 2:
Reagente A: solução aquosa de cloreto de hidrogênio.
Reagente B: pó de carbonato de sódio.
Produtos: água líquida, gás carbônico e solução aquosa de cloreto de sódio.
Designando por I a massa inicial de cada conjunto (antes da mistura) e por F1 e F2 suas massas finais (após misturar) tem-se:
a) Experimento 1: F1 = I; experimento 2: F2 = I
b) Experimento 1: F1 = I; experimento 2: F2 > I
c) Experimento 1: F1 = I; experimento 2: F2 < I
d) Experimento 1: F1 > I; experimento 2: F2 > I
e) Experimento 1: F1 < I; experimento 2: F2 < I
Alternativa “c”.
Como o béquer é um sistema aberto, o gás carbônico formado no experimento 2 abandona o sistema, de modo que nesse experimento a massa final é menor que a massa inicial.
(Fuvest 2008)Devido à toxicidade do mercúrio, em caso de derramamento desse metal, costuma-se espalhar enxofre no local, para removê-lo. Mercúrio e enxofre reagem, gradativamente, formando sulfeto de mercúrio. Para fins de estudo, a reação pode ocorrer mais rapidamente se as duas substâncias forem misturadas num almofariz. Usando esse procedimento, foram feitos dois experimentos. No primeiro, 5,0 g de mercúrio e 1,0 g de enxofre reagiram, formando 5,8 g do produto, sobrando 0,2 g de enxofre. No segundo experimento, 12,0 g de mercúrio e 1,6 g de enxofre forneceram 11,6 g do produto, restando 2,0 g de mercúrio.
Mostre que os dois experimentos estão de acordo com a lei da conservação da massa (Lavoisier) e a lei das proporções definidas (Proust).
Mercúrio + Enxofre → Sulfeto de mercúrio Excesso
I. 5,0 g 1,0 g 5,8 g 0,2 g de enxofre
II. 12,0 g 1,6 g 11,6 g 2,0 g de mercúrio
Massas que reagiram efetivamente:
Mercúrio + Enxofre → Sulfeto de mercúrio Excesso
I. 5,0 g 0,8 g 5,8 g 0,2 g de enxofre
II. 12,0 g 1,6 g 11,6 g 2,0 g de mercúrio
Massa de mercúrio= 5,00 = 10,0 = 6,25
Massa de enxofre 0,8 1,6






