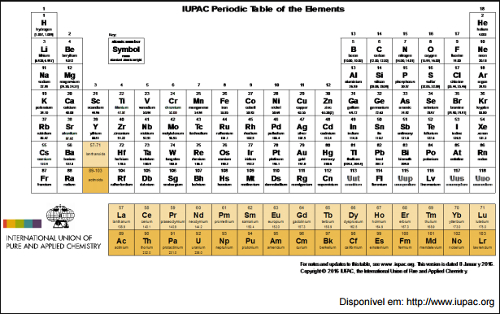
Exercícios sobre os novos elementos da tabela periódica
(UFU-MG) Welcome to the International Union of Pure and Applied Chemistry Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118 IUPAC announces the verification of the discoveries of four new chemical elements: The 7th period of the periodic table of elements is complete.
Foi assim que, em 30 de dezembro de 2015, a IUPAC (sigla, em inglês, de International Union of Pure and Applied Chemistry) anunciou, formalmente, a inclusão de novos elementos na Tabela Periódica: Unúntrio (113Uut), Unumpêntio (115Uup), Ununséptio (117Uus) e Ununóctio (118Uuo). Esses novos elementos transurânicos possuem grandes núcleos e são:
a) naturais e de peso atômico elevado.
b) artificiais e altamente radioativos.
c) isoeletrônicos e isótopos entre si.
d) estáveis com semelhança no tempo de vida.
Letra b). Os novos elementos da tabela periódica, de números atômicos 113, 115, 117 e 118, são denominados artificiais e radioativos por apresentarem números atômicos maiores que 83 e 92.
(Uece) As pesquisas sobre novos elementos químicos prosseguem e os cientistas já aventam a possibilidade da existência do elemento de número atômico 117. Sobre tal elemento, assinale o correto.
a) Apresenta 7 níveis eletrônicos.
b) Seu elétron diferencial apresenta os seguintes valores de números quânticos: n = 7; l = 1; ml = 0 e ms = –1/2.
c) É diamagnético.
d) Pertence à mesma família do enxofre.
Letra a). Podemos afirmar que o elemento de número atômico 117 possui 7 níveis eletrônicos, pelo fato de ele estar posicionado no sétimo período da tabela periódica. Já as outras alternativas estão incorretas porque:
b- Após fazer a sua distribuição eletrônica:
Observa-se que seu elétron de diferenciação (último elétron) está no subnível 7p5. Quando distribuirmos esses elétrons nos orbitais p, o último elétron está no orbital de número 0, porém ele é o segundo dentro do orbital, o que caracteriza spin +1/2.
c- Como existe um elétron desemparelhado em seu orbital p, o elemento 117 é paramagnético.
d- Ele pertence à família do flúor, ou seja, a família dos halogênios.
O elemento de número atômico 113 foi descoberto em 2003, por um trabalho em conjunto de russos, do laboratório de Dubna, e norte-americanos, do laboratório de Livermore. A confirmação dessa descoberta foi feita por cientistas japoneses em 2012. Trata-se de um elemento que se apresenta no estado sólido, com propriedades de um metal, com baixa reatividade, radioativo e instável. Sobre esse elemento, podemos afirmar que o nome atribuído a ele e o número de prótons no interior do seu núcleo são:
a) Oganosseno, 113
b) Moscóvio, 113
c) Tensessine, 113
d) Nihônio, 113
e) nda.
Letra d). O número de prótons do elemento é 113 porque seu número atômico é igual a 113. O nome Nihônio foi atribuído a ele em homenagem ao país em que esse elemento foi descoberto, o Japão, já que a palavra Nihon significa terra do sol nascente.
O elemento químico de número atômico 118, posicionado no sétimo período da família VIIIA da tabela periódica, que recebeu o nome Oganosseno, foi proposto pelos pesquisadores do Instituto de Pesquisa Nuclear de Dubna e do Laboratório Nacional de Lawrence Livermore, nos Estados Unidos, em homenagem ao pesquisador e professor Yuri Oganessian, que foi o pioneiro no estudo dos elementos transactinoides. A família do elemento de número atômico 118 é conhecida pela nomenclatura:
a) Metais alcalinoterrosos
b) Halogênios
c) Calcogênios
d) Família do Boro
e) Gases nobres
Letra e). Como o elemento 118 está posicionado no grupo 18 da tabela periódica, ele está no grupo dos gases nobres. As outras alternativas estão erradas porque:
a) Nome dado ao grupo 2.
b) Nome dado ao grupo 7.
c) Nome dado ao grupo 6.
d) Nome dado ao grupo 3.