Exercícios sobre pilhas e baterias primárias
(UnB-DF) As pilhas vendidas no comércio para uso em lanternas, rádios e outros aparelhos elétricos constituem-se fundamentalmente de uma cápsula de zinco, uma solução aquosa de eletrólitos (ZnCl2 + NH4Cl), dióxido de manganês e um bastão de grafita.
A figura representa um corte longitudinal de uma pilha de manganês.
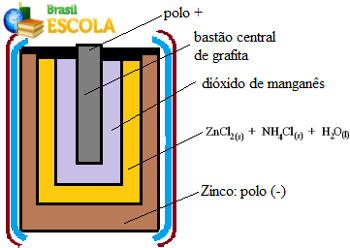
Representação do interior de uma pilha de manganês ou pilha seca de Leclanché
Durante o funcionamento desta pilha, ocorrem as seguintes reações:
No ânodo: Zn(s) →Zn2+(aq) + 2e-.
No cátodo: 2MnO2(s) + 2NH4+(aq) + 2e- → Mn2O3(s) + 2NH3(aq) + H2O(l)
Julgue os itens que se seguem.
0. Mn4+ é o agente redutor.
1. Durante o funcionamento desta pilha, o fluxo de elétrons ocorre no sentido grafita → zinco.
2. A reação total da pilha é:
Zn(s) + Mn2O3(s) + 2 NH3(aq) + H2O(l) → Zn2+(aq) + 2MnO2(s) + 2NH4+ + 4e-
3. A quantidade de Zn2+ diminui durante o funcionamento da pilha.
4. A pilha cessará seu funcionamento quando o MnO2 for totalmente consumido.
Apenas o item 4 está correto.
Veja por que as demais alternativas estão erradas:
0. O agente redutor é o Zn.
Fazendo a somatória dos dois eletrodos, temos a seguinte reação global:
Zn0(s) ↔ Zn2+(aq) + 2 e-
2MnO2(s) + 2NH4+(aq) + 2e- ↔ Mn2O3(s) + 2NH3(aq) + H2O(l)
Zn0(s) +2MnO2(s) + 2NH4+(aq)↔ Zn2+(aq) + Mn2O3(s) + 2NH3(aq) + H2O(l)
Zn0(s)→ oxidação → Zn2+(aq)
Mn4+ (MnO2(s))→ redução → Mn3+ (Mn2O3(s))
Zn0(s)→ oxidação → agente redutor
MnO2(s)→ redução → agente oxidante
1. Veja que o zinco oxidou, o que significa que ele perdeu elétrons, logo o fluxo de elétrons ocorreu no sentido zinco → grafita.
2. A reação global da pilha é dada por: Zn0(s) +2MnO2(s) + 2NH4+(aq) ↔ Zn2+(aq) + Mn2O3(s) + 2NH3(aq) + H2O(l)
3. A quantidade de Zn2+ aumenta em virtude da perda de elétrons durante o funcionamento da pilha.
(Cesgranrio-RJ) As pilhas alcalinas entraram em moda recentemente e são usadas em quase tudo que exige um trabalho contínuo e duradouro, desde relógios de pulso até calculadoras eletrônicas. Uma das pilhas mais usadas é a de níquel/cádmio, que chega a ter uma duração maior do que a da bateria de automóvel e ainda pode ser recarregada várias vezes. Ela é constituída pelo metal cádmio, hidróxido de níquel III e uma pasta de hidróxido de potássio. Considere que os potenciais-padrão de redução são:
Cd2+(s)+ 2 e- → Cd0(s) -0,4 V
Ni3+(s) + 1 e- → Ni2+(s) +1,0 V
Entre as opções a seguir, indique a que apresenta o sentido do fluxo de elétrons e a força eletromotriz da pilha níquel-cádmio.
a) Do eletrodo de cádmio para o eletrodo de hidróxido de níquel III; +1,4 V.
b) Do eletrodo de cádmio para o eletrodo de hidróxido de níquel III; +11,6 V.
c) Do eletrodo de cádmio para o eletrodo de hidróxido de níquel III; +2,4 V.
d) Do eletrodo de hidróxido de níquel III para o eletrodo de cádmio; +1,4 V.
e) Do eletrodo de hidróxido de níquel III para o eletrodo de cádmio; +2,4 V.
Alternativa “a”.
Pelos valores dos potenciais-padrão de redução dados, sabemos que o níquel tem maior tendência para reduzir-se, então ele é o cátodo e o cádmio é o ânodo, ou seja, o cádmio perde elétrons e o níquel ganha, mostrando que o sentido do fluxo de elétrons é do eletrodo de cádmio para o eletrodo de hidróxido de níquel III:
2 Ni3+(s) + 2 e- → 2 Ni2+(s) +1,0 V
Cd2+(s)+ 2 e- → Cd0(s) +0,4 V
A ddp da pilha é a soma dos potenciais das semirreações: +1,40 V
Nas pilhas alcalinas ocorre a seguinte reação total:
Mn + Zn2+ → Mn2+ + Zn ∆E0 = 0,42 V
Sabendo que o potencial de redução do zinco é +0,76, quais serão as reações de oxidação e redução que ocorrem nessa pilha?
a) oxidação: Zn2+ + 2e- → Zn; redução: Mn → Mn2+ + 2 e-
b) oxidação: Mn2+ + 2 e-→ Mn ; redução: Zn → Zn2+ + 2e-
c) oxidação: Zn2+ → Zn+ 2e-; redução: Mn + 2 e- → Mn2+
d) oxidação: Mn + 2 e-→ Mn2+; redução: Zn2+ → Zn + 2e-
e) oxidação: Mn → Mn2+ + 2 e-; redução: Zn2+ + 2e- → Zn
Alternativa “e”.
Pela própria equação global já é possível concluir que o Mn sofre oxidação (perdendo dois elétrons e transformando-se no íon Mn2+) e o íon Zn2+ sofre redução (ganhando dois elétrons e transformando-se no zinco metálico). O valor do potencial de redução nos confirma isso:
∆E0 = EZn + EMn
EMn = ∆E0 - EZn
EMn = 0,42 - 0,76
EMn = -0,34 V
Veja que o potencial de redução do zinco (+0,76) é maior que o do manganês (-0,34). Assim, são os íons zinco que realmente sofrem redução.
Sobre a relação entre pilhas alcalinas e as pilhas comuns ou de Leclanché, julgue os itens a seguir:
a) As pilhas alcalinas não apresentam reações secundárias, o que aumenta o seu prazo de validade.
b) As pilhas alcalinas não geram valores de corrente elétrica suficientes para o funcionamento de equipamentos como câmeras digitais, filmadoras e alguns brinquedos.
c) As pilhas comuns apresentam reações secundárias que podem reduzir seu prazo de validade.
d) As pilhas alcalinas apresentam reações secundárias que podem resultar em produtos no estado gasoso, cuja pressão interna provoca rompimento do lacre e vazamento.
e) Tanto as pilhas alcalinas quanto as pilhas comuns são primárias, não podendo ser recarregadas.
f) As pilhas comuns não apresentam metais pesados como cádmio, mercúrio e chumbo.
g) O recipiente externo das pilhas alcalinas são confeccionados com chapas de aço para prevenir vazamentos.
a) Verdadeiro. As pilhas alcalinas não apresentam reações secundárias, o que aumenta o seu prazo de validade.
b) Falso. São as pilhas comuns, e não as pilhas alcalinas, que não conseguem gerar valores de corrente elétrica suficientes para o funcionamento de equipamentos como câmeras digitais, filmadoras e alguns brinquedos.
c) Verdadeiro. As pilhas comuns apresentam reações secundárias que podem reduzir seu prazo de validade.
d) Falso. São as pilhas comuns, e não as pilhas alcalinas, que apresentam reações secundárias, que, por sua vez, podem resultar em produtos no estado gasoso, cuja pressão interna provoca rompimento do lacre e vazamento.
e) Verdadeiro. Tanto as pilhas alcalinas quanto as pilhas comuns são primárias, não podendo ser recarregadas.
f) Falso. São as pilhas alcalinas, e não as pilhas comuns, que não apresentam metais pesados como cádmio, mercúrio e chumbo.
g) Verdadeiro. O recipiente externo das pilhas alcalinas são confeccionados com chapas de aço para prevenir vazamentos.





