Exercícios sobre pilhas e baterias
Numa pilha eletroquímica sempre ocorre:
a) Redução no ânodo.
b) Movimentação de elétrons no interior da solução eletrolítica.
c) Passagem de elétrons, no circuito externo, do cátodo para o ânodo.
d) Reação de neutralização.
e) Uma reação de oxirredução.
Alternativa “e”.
a) No ânodo ocorre uma oxidação.
b) A movimentação de elétrons ocorre nos eletrodos.
c) A passagem de elétrons é do ânodo para o cátodo.
d) A reação que ocorre é de oxirredução e não de neutralização (esta é um tipo de reação que ocorre entre ácidos e bases).
e) Correta.
As pilhas e as baterias são dispositivos nos quais uma reação espontânea de oxidorredução transforma energia química em energia elétrica. Portanto, sempre há uma substância que se reduz, ganhando elétrons, que é o cátodo, e uma que se oxida, perdendo elétrons, que é o ânodo. Abaixo, temos um exemplo de uma pilha eletroquímica:
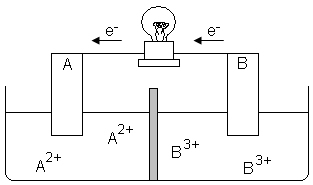
A respeito dessa pilha, responda:
a) Qual eletrodo, A ou B, está sofrendo redução e qual está sofrendo oxidação?
b) Qual eletrodo é o cátodo e qual é o ânodo?
c) Escreva a semirreação que ocorre nos eletrodos A e B e a reação global da pilha.
d) A concentração dos íons B3+ e A2+ aumenta ou diminui?
e) Ocorre corrosão ou deposição dos eletrodos A e B?
a) O eletrodo A está sofrendo redução, porque está ganhando elétrons, portanto, seu Nox (Número de Oxidação) irá diminuir. Já o eletrodo B está sofrendo oxidação, porque está perdendo elétrons e seu Nox irá aumentar.
b) O eletrodo A é o cátodo e o B é o ânodo.
c) Semirreação do ânodo: B(s) → B3+(aq) + 3 e-
Semirreação do cátodo: A2+(aq) + 2 e- → A(s)
Para encontrar a equação que representa a reação global dessa pilha, teremos que multiplicar a semirreação do ânodo por 2 e a do cátodo por 3, para poder igualar os elétrons que foram transferidos e recebidos nos eletrodos:
Semirreação do ânodo: 2 B(s) → 2 B3+(aq) + 6 e-
Semirreação do cátodo: 3 A2+(aq) + 6 e- → 3 A(s)
Reação Global: 2 B(s) +3 A2+(aq) → 2 B3+(aq)+ 3 A(s)
d) Conforme mostra a reação global, a concentração de B3+ aumenta e de A2+ diminui.
e) Haverá deposição sobre o eletrodo A e corrosão do eletrodo B.
(UFU-MG) Quando a pilha mostrada a seguir está em funcionamento, a barra de chumbo vai se desgastando e a prata vai ficando mais espessa.
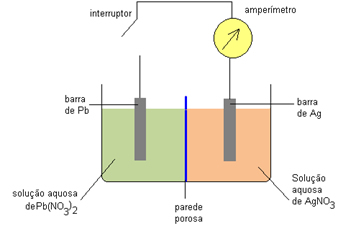
No início do experimento, as duas barras apresentavam as mesmas dimensões. Para essa pilha determine:
a) As equações das semirreações de oxidação e redução;
b) A equação química da reação global;
c) O sentido de movimento dos elétrons na parte externa do circuito e o sentido dos íons na parede porosa.
a) Semirreação do ânodo: 1 Pb(s) → 1 Pb2+(aq) + 2e-
Semirreação do cátodo: 2 Ag2+(aq) + 2e-→2 Ag(s)
b) Reação Global: 1 Pb(s) 2 Ag2+(aq) → 1 Pb2+(aq) + 2 Ag(s)
c) Os elétrons movimentam-se do ânodo (eletrodo de chumbo) para o cátodo (eletrodo de prata). Os cátions dirigem-se do ânodo para o cátodo e os ânions dirigem-se do cátodo para o ânodo.
(Vunesp) A equação seguinte indica as reações que ocorrem em uma pilha:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Podemos afirmar que:
a) O zinco metálico é o cátodo.
b) O íon cobre sofre oxidação.
c) O zinco metálico sofre aumento de massa.
d) O cobre é o agente redutor.
e) Os elétrons passam dos átomos de zinco metálico aos íons de cobre.
Alternativa “e”.
a) O zinco metálico é o ânodo, ele perde elétrons: Zn(s) → Zn2+(aq) + 2e-.
b) O íon cobre sofre redução, ele ganha elétrons: Cu2+(aq) + 2 e-→ Cu(s).
c) O zinco metálico é o ânodo que é corroído, porque ele sofre oxidação e, com isso, a massa da barra diminui.
d) O cobre é o agente oxidante, pois ele causou a oxidação do zinco.
e) Correta.






