Exercícios sobre o produto iônico da água
Em uma análise realizada com a água (H2O) a 90oC, um químico encontrou uma quantidade de hidrônios (H3O+) igual a 5.10-7 mol/L e de hidróxidos igual a 5.10-7 mol/L. Qual será o valor da constante de ionização da água nessa temperatura?
a) 2,5. 10-14
b) 25.10-14
c) 25.10-7
d) 25
e) 1.10-7
Letra b). Os dados fornecidos pelo exercício foram:
-
[H3O+] = 5.10-7 mol/L
-
[OH-] = 5.10-7 mol/L
-
Kw = ?
Basta aplicá-los na expressão da constante de autoionização da água:
Kw = [H3O+].[OH-]
Kw= 5.10-7.5.10-7
kw = 25.10-14
Entre os fatores propostos abaixo, qual é o único capaz de modificar o valor da constante de ionização da água (Kw)?
a) Aumento da concentração de hidróxidos
b) Diminuição da concentração de hidrônios
c) Aumento da concentração de hidrônios
d) Temperatura
Letra d). Assim como toda e qualquer constante de equilíbrio, apenas a variável temperatura é capaz de modificar o seu valor.
Qual das expressões abaixo representa a equação para calcular a constante de ionização da água (Kw)?
a) Kw = [OH-]
H2O
b) Kw = [H3O+]
H2O
c) Kw = [H3O+].[OH-]
d) Kw = [H3O+].[OH-]
H2O
e) Kw = H2O
[H3O+].[OH-]
Letra c). A expressão da constante de ionização da água é construída a partir da equação de ionização da água:
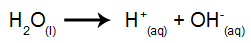
Para montar a expressão, devemos multiplicar as concentrações dos produtos da equação e dividir pelo reagente. A água não entra na expressão por ser um componente líquido.
Kw = [H3O+].[OH-]
Sabe-se que a água apresenta baixos valores para o grau de ionização e para a constante de ionização no equilíbrio (Kc), fatores que fazem com que ela tenha uma baixa condutividade elétrica. Por todos esses fatores, podemos considerar a água como um eletrólito:
a) molecular
d) forte.
c) moderado.
d) fraco.
Letra d). As outras alternativas estão incorretas porque:
a): a água não é um eletrólito molecular por ser capaz de sofrer autoionização, ou seja, produzir um cátion e um ânion, sendo, portanto, um eletrólito iônico.
b) e c): a água é um eletrólito que apresenta baixo grau de ionização.






