Exercícios sobre reações inorgânicas
(UFMG) Colocando-se um frasco de ácido clorídrico junto a outro de amônia e retirando-se as rolhas de ambos, nota-se a formação de fumaça branca intensa, constituída de cloreto de amônio (HCl + NH3 → NH4Cl).
Esta experiência é um exemplo de:
a) síntese.
b) decomposição.
c) reação de substituição.
d) reação de dupla troca.
e) sublimação.
Alternativa “a”.
É uma reação de síntese porque dois reagentes combinam-se para originar um único produto.
(FEI-SP) As equações químicas:
Zn + 2 HCl → ZnCl2 + H2
P2O5+ 3 H2O → 2 H3PO4
AgNO3 + NaCl → AgCl + NaNO3
CaO + CO2 → CaCO3
N2O4 → 2 NO2
Representam, respectivamente, reações de:
a) Dupla troca, adição, análise, deslocamento e decomposição.
b) Dupla troca, adição, análise, simples troca e decomposição.
c) Simples troca, dupla troca, síntese, análise e deslocamento.
d) Deslocamento, síntese, dupla troca, adição e análise.
e) Síntese, dupla troca, simples troca, análise e adição.
Alternativa “d”.
Zn + 2 HCl → ZnCl2 + H2: Reação de simples troca ou deslocamento, pois uma substância simples (Zn) reage com uma composta (HCl), originando uma nova substância simples (H2) e outra composta (ZnCl2).
P2O5+ 3 H2O → 2 H3PO4: Reação de síntese ou adição, pois dois reagentes combinam-se para originar um único produto.
AgNO3 + NaCl → AgCl + NaNO3: Reação de dupla troca, pois duas substâncias compostas reagem entre si, trocando seus componentes e dando origem a duas substâncias compostas novas.
CaO + CO2 → CaCO3: Reação de síntese ou adição, pois dois reagentes combinam-se para originar um único produto.
N2O4 → 2 NO2 : Reação de análise ou decomposição, pois uma substância origina duas outras moléculas.
Indique qual das alternativas a seguir mostra uma reação de análise:
a) N2 + 3 H2 → 2 NH3
b) 2 HNO3 + Ca(OH)2 → 2 Ca(NO3)2 + 2 H2O
c) BaCl2 + H2SO4 → BaSO4 + 2 HCl
d) Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2
e) C12H22O11 → 12 C + 11H2O
Alternativa “e”.
a) Reação de adição.
b) Reação de dupla troca.
c) Reação de dupla troca.
d) Reação de dupla troca.
O consumo de ácido sulfúrico pode ser utilizado como um indicador do desenvolvimento de um país. Industrialmente, esse ácido pode ser obtido a partir da pirita de ferro, que consiste basicamente em sulfeto ferroso (FeS). Classifique as equações de obtenção industrial do ácido sulfúrico:
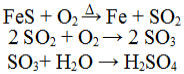
Equações de obtenção do ácido sulfúrico
a) dupla troca, análise, análise.
b) simples troca, síntese, síntese.
c) dupla troca, síntese, síntese.
d) simples troca, análise, análise.
e) decomposição, síntese, síntese.
Alternativa “b”.






