Exercícios sobre velocidade das reações
(UESC) A água oxigenada, H2O2, decompõe-se, produzindo água e gás oxigênio, de acordo com a equação:
H2O2(aq) → H2O + ½ O2
O gráfico abaixo foi construído a partir de dados experimentais e mostra a variação da concentração de água oxigenada em função do tempo. Qual será a velocidade média de decomposição da água oxigenada nos intervalos I, II eIII?
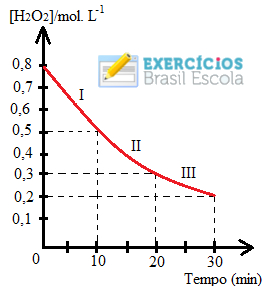
Gráfico em exercício sobre velocidade das reações químicas
a) 0,03 mol . L-1 . min-1; 0,02 mol . L-1 . min-1; 0,01 mol . L-1 . Min-1.
b) -0,03 mol . L-1 . min-1; -0,02 mol . L-1 . min-1; -0,01 mol . L-1 . Min-1.
c) 0,8 mol . L-1 . min-1; 0,5 mol . L-1 . min-1; 0,3 mol . L-1 . Min-1.
d) 0,5 mol . L-1 . min-1; 0,3 mol . L-1 . min-1; 0,2 mol . L-1 . min-1.
e) 0,8 mol . L-1 . min-1; 0,05 mol . L-1 . min-1; 0,015 mol . L-1 . min-1.
Alternativa “a”.
* Intervalo I: * Intervalo II: * Intervalo III:
Vm = ∆[ H2O2] Vm = ∆[ H2O2] Vm = ∆[ H2O2]
∆t ∆t ∆t
Vm = [(H2O2)final-(H2O2)inicial] Vm = [(H2O2)final-(H2O2)inicial] Vm = [(H2O2)final–(H2O2)inicial]
tfinal – tinicial tfinal – tinicial tfinal – tinicial
Vm = [0,5-0,8] Vm = [0,3-0,5] Vm = [0,2-0,3]
10-0 20-10 30-20
Vm = [-0,3] Vm = [-0,2] Vm = [-0,1]
10 10 10
Como está em módulo e não existe velocidade negativa, o resultado é positivo:
Vm = 0,03 Vm = 0,02 Vm = 0,01
(UECE) Seja a reação: X → Y + Z. A variação na concentração de X em função do tempo é:
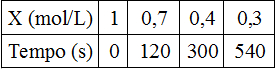
Tabela em exercício sobre velocidade média de uma reação química
A velocidade média da reação no intervalo de 2 a 5 minutos é:
a) 0,3 mol/L.min.
b) 0,1 mol/L.min.
c) 0,5 mol/L.min.
d) 1,0 mol/L.min.
e) 1,5 mol/L.min.
Alternativa “b”.
Tendo em vista que 2 minutos = 120 segundos e que 5 minutos = 300 segundos, temos:
Vm = ∆[X]
∆t
Vm = [Xfinal - Xinicial]
tfinal – tinicial
Vm = [0,4-0,7] mol/L
(5-2) min
Vm = [-0,3]mol/L
3 min
Vm = 0,1 mol/L.min.
Considere a reação química de decomposição do gás pentóxido de dinitrogênio:
2 N2O5(g) → 4 NO4(g) + O2(g)
O gráfico abaixo foi construído com os dados obtidos em um experimento envolvendo essa transformação a 55ºC e que estão descritos na tabela abaixo:
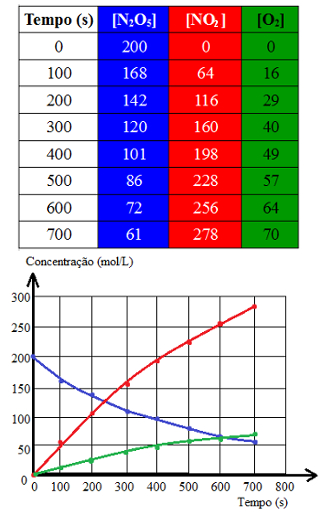
Tabela e gráfico de experimento com decomposição de pentóxido de dinitrogênio
Qual é a velocidade média aproximada de consumo de N2O4 e de formação do NO2 no intervalo de 200 s a 300s?
a) 0,3 mol/L.s e 0,6 mol/L.s
b) 0,15 mol/L.s e 0,3 mol/L.s
c) -0,2 mol/L.s e 0,4 mol/L.s
d) -0,2 mol/L.s e 0,5 mol/L.s
e) 0,2 mol/L.s e 0,4 mol/L.s
Alternativa “e”.
Vm(N2O4) = ∆[N2O4] Vm(NO2) = ∆[NO2]
∆t ∆t
Vm(N2O4) = [N2O4 final - N2O4 inicial] Vm(NO2) = [ NO2 final - NO2 inicial]
tfinal – tinicial tfinal – tinicial
Vm(N2O4) = [120-142] mol/L Vm(NO2) = [160-116] mol/L
(300-200) s (300-200) s
Vm(N2O4) = [-22]mol/L Vm(NO2) = [44]mol/L
100 s 100 s
Vm(N2O4) = 0,22 mol/L.s Vm(NO2) = 0,44 mol/L.s
Foi adicionado 0,50 g de magnésio metálico a uma solução diluída de ácido clorídrico. Após 10 s, restou 0,40 g de magnésio sem reagir. A interação ocorreu segundo a reação :
Mg(s) + 2 HCl(aq) → MgCl2(aq)+ H2(g)
Qual é a velocidade média aproximada dessa reação no intervalo de tempo de 10 s, expressa em mol/s?
Dado: Mg = 24 g/mol.
a) 4,2 mol/s
b) 0,01 mol/s
c) 4,2 . 10-4 mol/s
d) 0,0042 mol/s
e) -4,2 . 10-4 mol/s
Alternativa “c”.
Vm(Mg) = ∆[Mg]
∆t
Vm(Mg) = [ Mg final - Mg inicial]
∆t
Vm(Mg) = [0,4-0,5] g
10 s
Vm(Mg) = [-0,1]g
10 s
Vm(Mg) = 0,01 g/s
1 mol ------- 24 g
x-------- 0,01g
x = 0,00042 mol/s
x = 4,2 . 10-4 mol/s






