Exercícios sobre primeira lei da termodinâmica
Esta lista de exercícios trata da primeira lei da termodinâmica, lei que expressa a relação entre a variação da energia interna, o calor e o trabalho.
Publicado por: Pâmella Raphaella MeloQuestões
-
Questão 1
(EsPCEx) Um gás ideal sofre uma transformação adiabática em que o meio externo realiza um trabalho sobre o gás. Podemos afirmar que nessa transformação:
a) a energia interna do gás diminui.
b) o calor trocado aumenta.
c) a pressão do gás diminui.
d) o volume do gás aumenta.
e) a temperatura do gás aumenta.
Letra e.
De acordo com a primeira lei da termodinâmica, em uma transformação adiabática o calor é nulo. Então, por meio da fórmula da primeira lei da termodinâmica, podemos observar que a variação de energia interna é positiva, enquanto o trabalho é negativo. Consequentemente, a temperatura e a pressão do gás aumentam. Para entender de vez a primeira lei da termodinâmica, clique aqui.
-
Questão 2
(FGV) Certa massa de gás ideal sofreu três transformações. A primeira, AB, foi isotérmica; a segunda, BC, foi isovolumétrica; e a terceira, CA, foi isobárica, como mostra a figura.
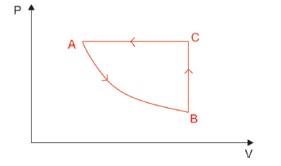
Considerando que o calor absorvido pelo gás seja positivo, que o calor cedido seja negativo, que o trabalho realizado pela força aplicada pelo gás no meio exterior seja positivo e que o trabalho realizado pela força aplicada pelo meio exterior sobre o gás seja negativo, montou-se o quadro a seguir.
Transformação
Calor envolvido
Trabalho realizado
Energia interna do gás
AB
positivo
positivo
X
BC
positivo
Y
aumenta
CA
Z
negativo
diminui
Completam, respectivamente, as células X, Y e Z do quadro:
a) não se altera, nulo e negativo.
b) não se altera, positivo e negativo.
c) aumenta, positivo e positivo.
d) aumenta, nulo e positivo.
e) diminui, negativo e nulo.
Letra A
De acordo com a primeira lei da termodinâmica, no trecho AB ocorre uma transformação isotérmica, com temperatura constante, então a variação de energia interna é nula e não se altera. No trecho BC ocorre uma transformação isovolumétrica, com volume constante, então o trabalho é nulo. E no trecho CA ocorre uma transformação isobárica, com pressão constante, em que o trabalho, o calor e a variação de energia interna são proporcionais. Então se o trabalho e a variação da energia interna são nulos, o calor também será nulo.
-
Questão 3
(Unimontes) Em uma compressão isotérmica, o trabalho realizado sobre o gás é 800 J. O calor cedido pelo gás no processo e a variação da energia interna, em joules, são iguais, respectivamente, a
a) 800, 800.
b) 800, -800.
c) zero, 800.
d) 800, zero
Letra D
De acordo com a primeira lei da termodinâmica, em uma compressão isotérmica, a variação da energia interna é nula. Já o calor pode ser calculado por meio da fórmula da primeira lei da termodinâmica:
\(∆U=Q-W\)
\(0=Q-800\)
\(Q=800\ J\)
-
Questão 4
(UFRGS) A figura abaixo apresenta o diagrama da pressão p(Pa) em função do volume V(m³) de um sistema termodinâmico que sofre três transformações sucessivas: XY, YZ e ZX.
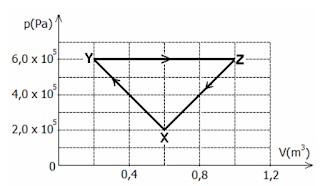
O trabalho total realizado pelo sistema após as três transformações é igual a
a) 0 J.
b) \(1,6\cdot 10^5\) J
c) \(2,0\cdot 10^5 \) J
d) \(3,2\cdot 10^5 \) J
e) \(4,8\cdot 10^5 \) J
Letra B
Podemos calcular o trabalho realizado pelo sistema por meio da área da figura do gráfico:
\(W=área\ do\ triângulo\)
\(W=\frac{base\cdot altura}2\)
A base é do ponto Y até o ponto Z, e a altura é do ponto X até a base, então:
\(W=\frac{0,8\cdot (6,0\cdot 10^5-2,0\cdot 10^5 )}2\)
\(W=\frac{0,8\cdot (4,0\cdot 10^5)}2\)
\(W=0,4\cdot 4,0\cdot 10^5\)
\(W=1,6\cdot 10^5\ J\)
-
Questão 5
Um sistema termodinâmico inicialmente possui uma energia interna de 45 000 J e, após sofrer uma variação de sua temperatura, a sua energia interna aumenta 80 000 J. Calcule a variação da energia interna desse sistema termodinâmico:
a) 35 000 J
b) 40 000 J
c) 45 000 J
d) 50 000 J
e) 55 000 J
Letra A
De acordo com a primeira lei da termodinâmica, podemos calcular a variação da energia interna utilizando a fórmula:
\(∆U=U_f-U_i\)
\(∆U=80 000-45 000\)
\(∆U=35 000\ J\)
-
Questão 6
Um gás sofre uma transformação isobárica, mantendo sua pressão em 10 Pa, enquanto o seu volume e temperatura aumentam, conforme o gráfico a seguir.
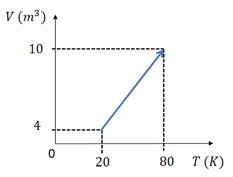
Considerando que o gás recebe 300 J de calor, calcule a variação de energia interna do gás.
a) 80 J.
b) 160 J.
c) 240 J.
d) 320 J.
e) 400 J.
Letra C
Primeiramente, calcularemos o trabalho sofrido pelo gás, por meio da fórmula que o relaciona à pressão e ao volume:
\(W = p\cdot ΔV\)
\(W = 10\cdot (10-4)\)
\(W = 10\cdot 6\)
\(W = 60\ J\)
Depois, calcularemos a variação de energia interna utilizando a fórmula da primeira lei da termodinâmica:
\(ΔU = Q - W\)
\(ΔU = 300 - 60\)
\(ΔU = 240\ J\)
-
Questão 7
Qual a quantidade de calor recebido por um gás que foi comprido por um trabalho de 400 J, sabendo que a variação da sua energia interna foi de 600 J?
a) 0 J
b) 200 J
c) – 200 J
d) 400 J
e) – 400 J
Letra B
De acordo com a primeira lei da termodinâmica, quando um gás é comprimido, o seu trabalho é negativo, então podemos calcular o calor por meio da fórmula da primeira lei da termodinâmica:
\(ΔU = Q - W\)
\(600 = Q - (-400)\)
\(600 = Q+400\)
\(Q = 600-400\)
\(Q = 200\ J\)
-
Questão 8
Um gás ideal sofre uma transformação isovolumétrica recebendo 120 cal de calor. Considerando isso, encontre a variação de energia interna e o trabalho feito pelo gás.
a) 0 cal e -120 cal
b) 50 cal e 0 cal
c) -120 cal e 0 cal
d) 120 cal e 120 cal
e) 0 cal e 120 cal
Letra E
De acordo com a primeira lei da termodinâmica, em uma transformação isotérmica, o trabalho feito pelo gás é nulo. A variação de energia interna pode ser calculada pela fórmula da primeira lei da termodinâmica:
\(∆U=Q-W\)
Como o gás está recebendo calor, o sinal é positivo, então:
\(∆U=120-0\)
\(∆U=120\ J \)
-
Questão 9
De acordo com seus estudos a respeito da primeira lei da termodinâmica, qual das alternativas corresponde ao seu objeto de estudo?
a) Conservação da energia.
b) Conservação do tempo.
c) Conservação da quantidade de movimento.
d) Conservação da massa.
e) Conservação da temperatura.
Letra A
O objeto de estudo da primeira lei da termodinâmica é a conservação da energia em sistemas termodinâmicos.
-
Questão 10
Um gás se expande adiabaticamente com um trabalho de 1000 J. Assim, encontre os valores da energia interna e do calor.
a) 1000 J
b) 500 J
c) – 1000 J
d) - 500 J
e) 0 J
Letra C
De acordo com a primeira lei da termodinâmica, em uma transformação adiabática o calor é nulo, já que não ocorrem trocas de calor com o meio. Já a energia interna pode ser calculada pela fórmula da primeira lei da termodinâmica:
\(∆U=Q-W\)
\(∆U=0-1000\)
\(∆U=-1000\ J\)
-
Questão 11
De acordo com a primeira lei da termodinâmica, quais são as grandezas físicas responsáveis pelo balanço de energia de um sistema termodinâmico?
a) Calor, energia interna e temperatura.
b) Trabalho, calor e energia interna.
c) Força, energia interna e volume.
d) Pressão, volume e temperatura.
e) Trabalho, calor e densidade.
Letra B
Na primeira lei da termodinâmica, as grandezas físicas trabalho, calor e energia interna são responsáveis pelo balanço de energia de um sistema termodinâmico.
-
Questão 12
Quais proposições apresentam a unidade de medida correspondente às grandezas físicas estudadas na primeira lei da termodinâmica?
I. A energia interna é medida em Pascal.
II. O calor é medido em Joule.
III. O trabalho é medido em Joule.
IV. A pressão é medida em Joule.
V. O volume é medido em metros.
a) Alternativas I e II.
b) Alternativas III e IV.
c) Alternativas I e V.
d) Alternativas II e III.
e) Alternativas IV e V.
Letra D
Abaixo, vemos a correção das alternativas incorretas.
I. Incorreta. A energia interna é medida em Joule.
II. Correta.
III. Correta.
IV. Incorreta. A pressão é medida em Joule.
V. Incorreta. O volume é medido em metros cúbicos.