Exercícios sobre Balanceamento por Oxirredução
No balanceamento por oxidorredução deve-se ter em mente que o objetivo é igualar o número de elétrons perdidos e recebidos.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Faça o balanceamento da equação a seguir:
K2Cr2O7(aq) + H2O(l) + S(g) → KOH(aq) + Cr2O3(s) + SO2(g)
2 K2Cr2O7(aq) + 2 H2O(l) + 3 S(g) → 4 KOH(aq) + 2 Cr2O3(s) + 3 SO2(g)
Passos:
1º passo: Determinar os números de oxidação:
+1 +6 -2 +1 -2 0 +1 -2 +1 +3 -2 +4 -2
K2Cr2O7(aq) + H2O(l) + S(g) → KOH(aq) + Cr2O3(s) + SO2(g)2º passo: Determinar a variação da oxidação e da redução:
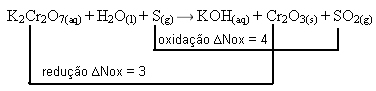
3º passo: Inversão dos valores de ∆:
K2Cr2O7= ∆Nox = 2 . 3 = 6 → 6 será o coeficiente de S
S= ∆Nox = 1 . 4 = 4→ 4 será o coeficiente de K2Cr2O7
4K2Cr2O7(aq) + H2O(l) + 6 S(g) → KOH(aq) + Cr2O3(s) + SO2(g)
4º passo: Balanceamento por tentativa:
4 K2Cr2O7(aq) + 4 H2O(l) + 6 S(g) → 8 KOH(aq) + 4 Cr2O3(s) + 6 SO2(g)
* Dividindo todos os coeficientes por 2 para ficar com os menores coeficiente inteiros:
2 K2Cr2O7(aq) + 2 H2O(l) + 3 S(g) → 4 KOH(aq) + 2 Cr2O3(s) + 3 SO2(g)
-
Questão 2
As reações a seguir representam as etapas envolvidas na obtenção de ácido acético (CH3CO2H) a partir de eteno (C2H4).
C2H4(aq) + O2(g) → CH3CHO(l)
eteno acetaldeídoCH3CHO(l)+ O2(g) → CH3CO2H
acetaldeído ácido acéticoA seguir são dadas as fórmulas estruturais do eteno, acetaldeído e do ácido acético:
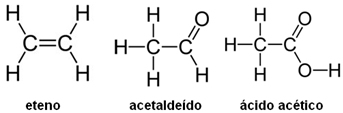
Determine:
a) o Nox dos átomos de carbono nos compostos orgânicos;
b) os agentes redutor e oxidante em ambas as reações;
c) balanceie as duas equações químicas.
a)
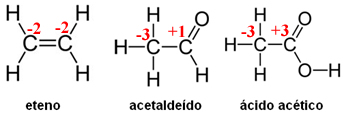
b) Em ambas as equações, o O2 (sofre redução) é o agente oxidante. Na primeira equação, o agente redutor é o eteno e na segunda, o acetaldeído.
c) 2 C2H4(aq) + 1 O2(g) → 2 CH3CHO(l)
2 CH3CHO(l)+ 1 O2(g) → 2 CH3CO2H
-
Questão 3
(PUC-SP modificada) Sabe-se que cobre metálico reage com ácido nítrico diluído e produz óxido de nitrogênio IV, água e um composto iônico no qual o cobre tem seu maior número de oxidação, dentre os dois mais comuns. Formule e ajuste a equação da reação entre cobre e ácido nítrico diluído.
1 Cu(s) + 4 HNO3(aq) → 2 NO2(g) + 1 Cu(NO3)2(aq) + 2 H2O(l)
Passos:
1º passo: Determinar os números de oxidação:
0 +1 +5 -2 +4 -2 +2 +5 -2 +1 -2
Cu(s) + HNO3(aq) → NO2(g) + Cu(NO3)2(aq) + H2O(l)2º passo: Determinar a variação da oxidação e da redução: ∆
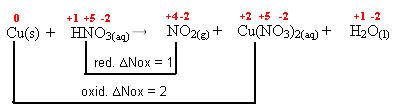
3º passo: Inversão dos valores de ∆:
NO2= ∆Nox = 1 . 1 = 1 → 1 será o coeficiente de Cu(NO3)2
Cu(NO3)2= ∆Nox = 1 . 2 = 2→ 2 será o coeficiente de NO2
Cu(s) + HNO3(aq) → 1 NO2(g) + 2 Cu(NO3)2(aq) + H2O(l)
4º passo: Balanceamento por tentativa:
1 Cu(s) + 4 HNO3(aq) → 2 NO2(g) + 1 Cu(NO3)2(aq) + 2 H2O(l)
-
Questão 4
Em 1856, Berthelot preparou metano segundo a reação representada pela equação abaixo, não balanceada:
CS2 + H2S + Cu → Cu2S + CH4
a) Acerte os coeficientes estequiométricos pelo método da oxidorredução.
b) Indique o elemento que se oxida mostrando a variação dos números de oxidação.
1 CS2 + 2 H2S + 8 Cu → 4 Cu2S + 1 CH4
Passos:
1º passo: Determinar os números de oxidação:
+4 -2 +1 -2 0 +1 -2 -4 +1
CS2 + H2S + Cu → Cu2S + CH42º passo: Determinar a variação da oxidação e da redução: ∆
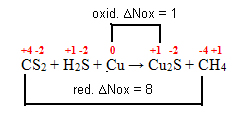
3º passo: Inversão dos valores de ∆:
CS2= ∆Nox = 1 . 8 = 8 → 8 será o coeficiente de Cu
Cu = ∆Nox = 1 . 1 = 1→ 1 será o coeficiente de CS2
1CS2 + H2S + 8Cu → Cu2S + CH4
4º passo: Balanceamento por tentativa:
1 CS2 + 2 H2S + 8 Cu → 4 Cu2S + 1 CH4