Exercícios sobre Carga Formal
Existem exceções à regra do octeto. Assim, para não ter dúvidas sobre a fórmula das moléculas e íons, basta realizar o cálculo da carga formal.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Abaixo foram propostas duas estruturas para a molécula de sulfato de hidrogênio (ácido sulfúrico, H2SO4). Realize o cálculo da carga formal e descubra qual delas tem maior probabilidade de existência real.
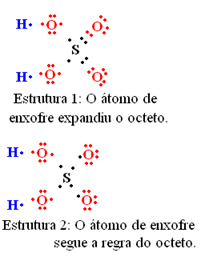
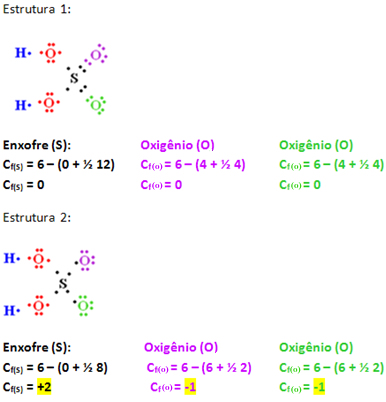
A estrutura 1 tem maior probabilidade de existência real, mesmo considerando que nessa estrutura o enxofre tenha expandido seu octeto. Isso é mostrado no cálculo da carga formal abaixo, em que os valores mais próximos de zero foram os dessa estrutura.
A fórmula da carga formal (Cfo) é:
Cf = V – (L + ½ S)
Em que:
V = quantidade de elétrons de valência do átomo livre;
L = quantidade de elétrons presentes nos pares isolados (não ligantes) do átomo na estrutura;
S = quantidade de elétrons compartilhados pelo átomo na estrutura.Realizaremos o cálculo da carga formal apenas para os átomos em destaque abaixo, pois os demais estão com arranjos iguais. Assim, temos:
-
Questão 2
Sabendo que o número atômico do Carbono é igual a 6 e o do oxigênio é igual a 8, e com base no cálculo da carga formal, prove que a estrutura 1 para o dióxido de enxofre (CO2) tem maior probabilidade de existência real:
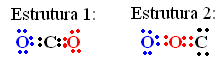
Embora nas duas estruturas todos os átomos completem o seu octeto, o cálculo da carga formal nos leva à conclusão de que a estrutura 1 é a mais provável:
Estrutura 1:
Oxigênio (O) Carbono (C): Oxigênio (O)
Cf(O) = 6 – (4 + ½ 4) Cf(C) = 4 – (0 + ½ 8) Cf(O) = 6 – (4 + ½ 4)
Cf(O) = 0 Cf(S) =0 Cf(O) = 0Estrutura 2:
Oxigênio (O) Carbono (C): Oxigênio (O)
Cf(O) = 6 – (4 + ½ 4) Cf(S) = 4 – (4 + ½ 4) Cf(O) = 6 – (0 + ½ 8)
Cf(O) = 0 Cf(C) = -2 Cf(O) = +2 -
Questão 3
(UFRGS/2005) Observe a estrutura eletrônica de Lewis sugerida para o N2O:
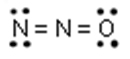
Nessa estrutura, as cargas formais dos átomos, lidos da esquerda para a direita, são, respectivamente:
a) zero, zero e zero.
b) -1, -1 e +2.
c) -1, +1 e zero.
d) +1, -1 e zero.
e) +3, +3 e -6.
Alternativa “c”
Observe o cálculo da carga formal dos elementos (da esquerda para a direita):

-
Questão 4
Determine a carga formal para o ânion tetrafluorborato (BF4-):
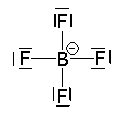
Neste caso, a carga formal (Cf) do boro [Cf(b)]e de cada átomo de flúor [Cf(f)] são iguais a:
Cf(b) = 3 – [ 0 + ½ 8] = -1.
Cf(f) = 7 – (6 + ½ 2) = 0.