Exercícios sobre a classificação das ligações sigma
Estes exercícios sobre as ligações sigma abordam os critérios utilizados para realizar a classificação desse tipo de ligação.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
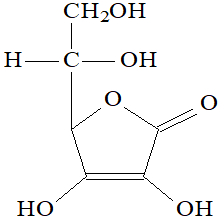
A fórmula estrutural a seguir pertence à vitamina C, também conhecida como ácido ascórbico, uma vitamina muito abundante em frutas cítricas como limão, laranja e acerola:
Analisando a fórmula da vitamina C, podemos afirmar que o número de ligações sigma do tipo s-p é igual a:
a) 1
b) 2
c) 3
d) 4
e) 5
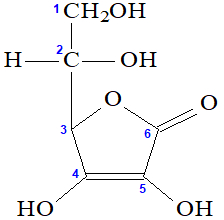
Letra d). Uma ligação sigma s-p ocorre apenas entre o elemento hidrogênio e elementos com orbitais p puros, como flúor, cloro, bromo, iodo, nitrogênio e oxigênio. Na estrutura da vitamina C, o hidrogênio realiza ligações sigma com carbono (numerados, na imagem a seguir, de 1 a 6), elemento que sofre hibridização, ou seja, não apresenta orbital p puro realizando ligação sigma, e o oxigênio (que possui).
Como há quatro hidrogênios realizando ligação com outros quatro oxigênios, existem, portanto, quatro ligações sigma do tipo s-p.
-
Questão 2
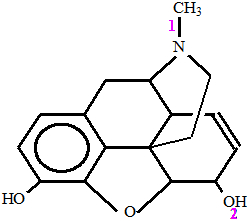
A morfina é uma droga muito utilizada para o alívio das dores extremas de pacientes, como aqueles acometidos de câncer em estágio terminal. Trata-se de uma substância orgânica, cuja fórmula estrutural está apresentada abaixo:
Analisando a estrutura da morfina, qual das alternativas a seguir indica o tipo de ligação sigma nas ligações de número 1 e 2?
a) 1-p-sp2, 2-s-sp3.
b) 1-p-sp3, 2-s-p.
c) 1-s-sp2, 2-s-sp.
d) 1-p-sp3, 2-p-sp3.
Letra b). Para responder essa questão, observe a seguinte análise:
-
Ligação 1: ocorre entre um carbono saturado (que faz apenas ligações simples), o que faz com que sua hibridização seja do tipo sp3, e o nitrogênio, que é um dos elementos que apresentam orbital p puro. Por essa razão, a ligação 1 é do tipo p-sp3.
Outros elementos com orbitais p puros são flúor, cloro, bromo, iodo, nitrogênio, oxigênio e fósforo.
-
Ligação 2: ocorre entre o elemento hidrogênio, que é o único que possui orbital s puro, e elemento oxigênio, que apresenta orbital p puro. Portanto, a ligação 2 é do tipo s-p.
-
-
Questão 3
(UFMS) O programa nacional de biocombustíveis tem despertado diferentes reações ao redor do mundo. Enquanto países como Estados Unidos e Japão consideram o etanol brasileiro uma alternativa viável aos combustíveis derivados de petróleo, Venezuela e Cuba criticam tanto a produção de álcool quanto a de biodiesel. Analisando a molécula de etanol (C2H6O), podemos considerar que as ligações hidrogênio-carbono e a ligação carbono-carbono são formadas pela interpenetração frontal de orbitais atômicos e híbridos, respectivamente, do tipo:
a) s – sp; sp – sp.
b) s – sp2; sp2 – sp2.
c) s – sp3; sp3 – sp3.
d) s – sp3; sp2 – sp2.
e) s – sp2; sp – sp.
Letra c). Para essa resposta, foi utilizado o seguinte critério:
-
Ligação carbono-hidrogênio: ocorre entre um carbono saturado (que faz apenas ligações simples), o que faz com que sua hibridização seja do tipo sp3, e o hidrogênio (que é um o único elemento que apresenta orbital s puro). Portanto, essa ligação é do tipo s-sp3.
-
Ligação carbono-carbono: ocorre entre dois carbonos saturados (que fazem apenas ligações simples), o que faz com que sua hibridização seja do tipo sp3. Portanto, a ligação é do tipo sp3-sp3.
-
-
Questão 4
(FURG-RS) De acordo com o tipo de orbital híbrido que toma parte na formação do orbital molecular, podem-se ter diversos tipos de ligações covalentes sigma. Com base nessa informação, assinale a alternativa correta:
a) Na molécula do etino, não existem ligações sigma, apenas pi.
b) Na molécula do propano, existem duas ligações entre os átomos de carbono do tipo θ sp3-sp3.
c) Todas as ligações entre os átomos de carbono e hidrogênio no etino são θ s-sp2.
d) Todas as ligações entre os átomos de carbono no 1,3-butadieno são θ sp-sp2.
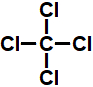
e) No tetracloreto de carbono, todas as ligações entre os átomos de carbono e cloro são do tipo θ s-sp2.
Letra b). Para responder essa questão, é necessário analisar a fórmula estrutural de cada um dos compostos descritos:
a- Falsa. Na molécula do etino, existe uma ligação tripla, a qual é caracterizada pela presença de uma ligação sigma e duas ligações pi.
b- Verdadeira. Os carbonos do tetracloreto de carbono fazem apenas ligações sigma, o que caracteriza hibridização do tipo sp3. Portanto, as ligações sigma entre eles são do tipo θ sp3-sp3.
c- Falsa. As ligações entre o hidrogênio e o carbono no etino não são do tipo θ s-sp2 porque os carbonos do etino fazem duas ligações pi, o que caracteriza hibridização do tipo sp. Assim, as ligações sigma são do tipo θ s-sp.
d- Falsa. As ligações entre os carbonos no buta-1,3-dieno não são do tipo θ sp-sp2 porque os carbonos fazem uma ligação dupla e duas simples, o que caracteriza hibridização do tipo sp2. Dessa forma, as ligações sigma são do tipo θ sp2-sp2.
e- Falsa. As ligações entre o hidrogênio e o carbono no tetracloreto de carbono não são do tipo θ s-sp2 porque os carbonos do tetracloreto de carbono fazem apenas ligações sigma, o que caracteriza hibridização do tipo sp3. Portanto, as ligações sigma são do tipo θ s-sp3.