Exercícios sobre Distribuição Eletrônica de Íons
Para realizar a distribuição eletrônica de íons, você deve se lembrar de que o ganho ou a perda de elétrons ocorre na camada mais externa e não na mais energética.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Quando um átomo se transforma em um íon, a variação do número de elétrons (ganho ou perda de elétrons) ocorre sempre na camada ou nível eletrônico mais externo, que é a camada de valência. Com base nisso, faça a distribuição eletrônica dos seguintes íons:
a) 26Fe2+
b) 26Fe3+
c) 15P3-
a) Primeiro realizamos a distribuição eletrônica do átomo de ferro (26Fe):
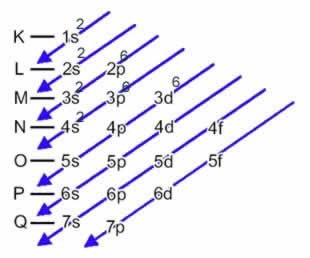
Assim, temos:
Distribuição eletrônica em ordem energética: 1s22s2 2p63s2 3p6 4s2 3d6
Distribuição eletrônica em ordem geométrica: 1s22s2 2p63s2 3p6 3d64s2
Visto que o ferro perdeu dois elétrons, conforme indicado pela carga +2, temos que retirar os dois elétrons do subnível mais externo, que é o 4s.
Portanto, a distribuição eletrônica do 26Fe2+ será: 1s22s2 2p63s2 3p6 3d6
b) Baseado no mesmo esquema do item anterior. No entanto, nesse caso, o ferro perdeu 3 elétrons. Como ocorre inicialmente a perda de dois elétrons contidos no subnível 4s, a camada mais externa do átomo de ferro passa a ser a terceira camada, onde o subnível 3d é agora o mais externo e no qual ocorrerá a saída do terceiro elétron. Assim, temos:
Distribuição eletrônica do 26Fe3+ será: 1s22s2 2p63s2 3p6 3d5
c) Primeiro realizamos a distribuição do fósforo:
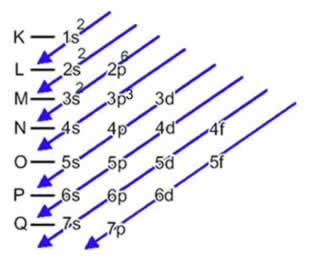
Assim, temos: 1s22s2 2p63s2 3p3
O íon 15P3- foi formado a partir do átomo de fósforo, pelo ganho de três elétrons, conforme indicado pela carga (-3), sendo que estes irão completar sua camada de valência. O subnível mais externo é o 3p e ele pode comportar no máximo 6 elétrons; portanto, ele pode receber os três elétrons que o fósforo ganhou.
Distribuição eletrônica do 15P3- será: 1s22s2 2p63s2 3p6
-
Questão 2
Qual alternativa indica o número de camadas utilizadas na distribuição eletrônica do cátion bivalente do cádmio, sendo que o seu número atômico é igual a 48?
a) 4
b) 5
c) 6
d) 9
e) 10
Alternativa “a”.
- Distribuição eletrônica do átomo de cádmio em ordem energética, segundo o diagrama abaixo: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10
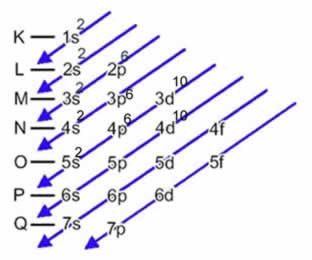
Veja que o subnível mais externo é o 5s. Assim, visto que o cádmio perdeu dois elétrons, tornando-se um cátion bivalente (carga 2+), os dois elétrons desse subnível serão retirados. Com isso, a camada mais externa será a 4.
-
Questão 3
(Fuvest – Sp) A seguir são mostradas quatro configurações eletrônicas:
- 1s2 2s2 2p6
- 1s2 2s2 2p6 3s2
- 1s2 2s2 2p6 3s2 3p5
- 1s2 2s2 2p6 3s2 3p6
a) Qual das configurações corresponde a cada um dos átomos Cl, Mg, Ne?
b) Quais configurações apresentam o mesmo número de elétrons na camada de valência? (Dados os números atômicos: Cl = 17, K = 19, Al = 13, Ne = 10 e Mg = 12).
a) 17Cl: 1s2 2s2 2p6 3s2 3p5 (III)
12Mg: 1s2 2s2 2p6 3s2 (II)
10Ne: 1s2 2s2 2p6 (I)
b) I. 8 elétrons na camada de valência
II. 2 elétrons na camada de valência
III. 7 elétrons na camada de valência
IV. 8 elétrons na camada de valência
Portanto, as configurações I e IV apresentam o mesmo número de elétrons na camada de valência.
-
Questão 4
(UFRGS-RS) O íon monoatômico A2- apresenta a configuração eletrônica 3s2 3p6 para o último nível. O número atômico do elemento A é:
a) 8
b) 10
c) 14
d) 16
e) 18
Alternativa “d”.
O íon ganhou 2 elétrons, conforme indicado pela carga 2- e então adquiriu a seguinte configuração 1s2 2s2 2p6 3s2 3p6. Lembre-se que quando ganha elétrons é feita uma modificação no subnível mais externo, acrescentando os elétrons ganhados, no caso o 3p. Isso significa que antes de ganhar os dois elétrons era assim: 1s2 2s2 2p6 3s2 3p4, que dá um total de 16.
A pergunta quer saber qual é o seu número atômico (número de prótons), que é igual ao número de elétrons no estado neutro. Portanto, o seu número atômico é 16.