Exercícios sobre Ebulioscopia
Ebulioscopia é uma propriedade coligativa que estuda a elevação do ponto de ebulição do solvente quando se adiciona mais soluto não volátil.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Em padarias e bares, o café é mantido quente em máquinas nas quais é usado o banho-maria. Isso é feito porque durante esse procedimento observa-se que:
a) Só o café ferve.
b) O café e a água do banho-maria fervem.
c) Só o banho-maria ferve.
d) O banho-maria ferve a uma temperatura maior que a da água pura;
e) O banho-maria ferve a uma temperatura menor que a da água pura.
“c”.
Quando queremos requentar uma solução de café, devemos evitar que ela entre em ebulição, pois isso provocaria uma alteração no sabor do café. O banho-maria é um procedimento que permite o aquecimento da solução de café, sem que se corra o risco da ebulição.
Durante esse procedimento, percebemos que a água do banho-maria entra em ebulição, o que não ocorre com a solução de café por mais que aqueçamos o sistema. Isso ocorre porque o ponto de ebulição da solução (café + água) é maior do que o do solvente puro (água pura).
-
Questão 2
Digamos que você possui as seguintes amostras:
Água pura.
Solução aquosa de glicose a 0,2 mol/L.
Solução aquosa de glicose a 0,4 mol/L.
A ordem crescente de temperatura de ebulição dessas amostras é dada por:
a) I > II > III
b) III > II > I
c) III < II < I
d) I < II < III
e) I < III < II
Alternativa “d”.
Quanto maior a concentração, isto é, a quantidade de partículas de glicose (soluto não volátil) dispersas no solvente (água pura), maior será a sua temperatura de ebulição.
-
Questão 3
Assinale V para verdadeiro ou F para falso nas afirmativas abaixo:
a) A pressão de vapor de um líquido diminui quando adicionamos a ele um soluto não volátil.
b) A temperatura de ebulição de uma solução de cloreto de sódio a 0,25 mol/L é menor do que a da água pura.
c) A temperatura de ebulição de uma solução de cloreto de sódio a 0,50 mol/L é igual à de uma solução de sacarose a 1,0 mol/L.
d) Os alimentos cozinham mais rápido em água pura, porque ela entra em ebulição a uma temperatura mais baixa do que a água de uma solução aquosa de sal.
a) (V)
b) (F)Na realidade, a temperatura de ebulição de uma solução de cloreto de sódio a 0,25 mol/L é maior do que a da água pura.
c) (V)
d) (F)O tempo de cozimento de um alimento depende da temperatura em que ele é preparado. Quando adicionamos o sal à água, a sua temperatura de ebulição aumenta, o que significa que a solução ficará mais quente do que se fosse apenas a água. Com isso, o tempo de cozimento do alimento diminui.
-
Questão 4
(PUC-RS) Dois recipientes iguais contêm líquidos em contínua ebulição. O recipiente 1 tem água pura e o recipiente 2 tem água do mar. O gráfico que melhor representa a variação das temperaturas dos líquidos em função do tempo é:
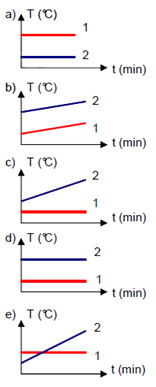
Alternativa “c”.
Visto que o recipiente 1 contém água pura, o seu ponto de ebulição é menor do que o do recipiente 2, que contém água do mar. Além disso, a água pura atinge o seu ponto de ebulição (a 100º C ao nível do mar) e suas moléculas passam para o estado de vapor. Portanto, o líquido atinge 100º C e permanece constante, até que todas as moléculas de água saiam do estado líquido. Já no caso da solução de água do mar, quando ela inicia a sua ebulição, com o passar do tempo, o solvente começa a evaporar, o que torna a solução mais concentrada. Assim, à medida que a ebulição avança, o ponto de ebulição continua a subir.
-
Questão 5
(UFPE) Foi observado que o cozimento de meio quilo de batatas em 1 litro de água é mais rápido se adicionarmos 200g de sal à água do cozimento. Considere as seguintes possíveis explicações para o fato:
I. A adição de sal provoca um aumento da temperatura de ebulição da água.
II. A adição de sal provoca um aumento da pressão de vapor.
III. O sal adicionado não altera a temperatura de ebulição da água, mas reage com o amido das batatas.
Está(ao) correta(s) a(s) explicação(ões):
a) I apenas.
b) II apenas.
c) III apenas.
d) I e II apenas.
e) I, II e III.
Alternativa “a”.
A II está errada porque a adição de sal faz com que a pressão de vapor da água diminua, devido às interações entre as partículas constituintes do sal com as moléculas de água. A explicação III está errada porque a adição de sal provoca sim um aumento da temperatura de ebulição da água, conforme dito da explicação I.
-
Questão 6
(UFRS) Apresenta maior ponto de ebulição ao nível do mar a solução:
a) 0,1 M de glicose
b) 0,5 M de glicose
c) 1,0 M de sacarose
d) 1,5 M de ureia
e) 1,5 M de NaCl
Alternativa “e”.
Primeiramente, sabe-se que quanto maior a concentração da solução, maior é o ponto de ebulição. Mas, a solução de ureia também tem concentração molar de 1,5 M, qual é a diferença entre as duas soluções?
A diferença é que o NaCl é um composto iônico, assim, em solução, seus íons se dissolvem, passando a ter mais partículas dissolvidas no meio do que a ureia.