Exercícios sobre a Eletrólise Ígnea do Cloreto de Sódio
A eletrólise do cloreto de sódio ou sal de cozinha fundido na ausência de água e de ar produz sódio metálico e gás cloro.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Na eletrólise ígnea do cloreto de sódio, obtém-se sódio metálico e cloro no ânodo. Escreva as semirreações anódica e catódica e a equação global que representa o processo.
Semirreação catódica: Na+(ℓ) + e- → Na(s)
Semirreação anódica: 2Cl-(ℓ) → 2 e- + 1Cl2(g)
Para escrever a reação global, temos que multiplicar a semirreação catódica por 2 para igualar a quantidade de elétrons transferidos:
Semirreação catódica: 2 Na+(ℓ) + 2 e- → 2 Na(s)
Semirreação anódica: 2Cl-(ℓ) → 2 e- + 1Cl2(g)
Reação Global: 2 Na+(ℓ) + 2Cl-(ℓ) → 2 Na(s) + 1Cl2(g) -
Questão 2
Abaixo, temos um esquema da eletrólise ígnea do cloreto de sódio:
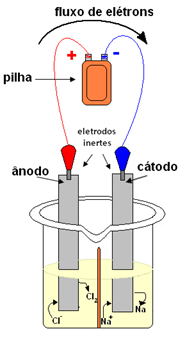
Esquema de processo de eletrólise ígnea do cloreto de sódio (sal de cozinha)Sobre esse processo é possível afirmar que:
a) A oxidação dos íons Na+ se dá no cátodo, polo negativo da célula.
b) Os cátions Na+ migram em direção ao eletrodo negativo, onde ocorre redução.
c) Elétrons migram do cátodo para o ânodo.
d) Cada íon Cl- perde dois elétrons.
e) Trata-se de um processo espontâneo de oxirredução.
Alternativa “b”.
a) Não ocorre a oxidação dos íons Na+ no cátodo, mas sim a sua redução, porque ao chegarem nesse polo negativo, os íons Na+ recebem elétrons do cátodo e se reduzem.
b) Correta.
c) Os elétrons migram do ânodo para o cátodo.
d) Cada íon Cl- perde um elétron, pois, conforme a semirreação do ânodo a seguir, dois íons Cl- perdem dois elétrons, sendo um elétron de cada: 2Cl-(ℓ) → 2 e- + 1Cl2(g)
e) A eletrólise é um processo não espontâneo.
-
Questão 3
(FUVEST) A eletrólise de cloreto de sódio fundido produzsódio metálico e gás cloro. Nesse processo, cada íon:
a) sódio recebe dois elétrons.
b) cloreto recebe um elétron.
c) sódio recebe um elétron.
d) cloreto perde dois elétrons.
e) sódio perde um elétron.
Alternativa “c”.
A eletrólise é um processo não espontâneo de descarga de íons. Assim, cada cátion sódio sofre redução (ganha um elétron) produzindo sódio metálico: Na+(ℓ) + e- → Na(s)
-
Questão 4
(PUCCamp) “Obtém-se sódio metálico por eletrólise do NaCl ....I.... . O processo deve ser realizado em ....II.... de ar, devido à ....III.... reatividade do metal obtido.”
Completa-se corretamente o texto acima quando as lacunas I, II e III são preenchidas, respectivamente, por:
a) Fundido, presença, baixa.
b) Fundido, ausência, alta.
c) Fundido, ausência, baixa.
d) Em solução aquosa, presença, baixa.
e) Em solução aquosa, ausência, alta.
Alternativa “b”.
A única maneira de se obter metais alcalinos, como o sódio metálico, e metais alcalinoterrosos (alta reatividade) é por meio de eletrólise ígnea de seus sais fundidos, na ausência de ar.