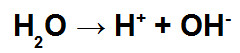Exercícios sobre a eletrólise da água
Esta lista de exercícios sobre a eletrólise da água aborda situações em que o cátion hidrônio e hidróxido, provenientes da água, sofrem descarga elétrica.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Um estudante de Química resolve realizar no laboratório um procedimento de eletrólise. Para tal, ele monta a célula eletrolítica com dois eletrodos inertes e adiciona, na cuba, água e sulfato de alumínio [Al2(SO4)3. Conhecendo as características do sulfato de alumínio e da água, qual são as substâncias formadas ao término dessa eletrólise?
a) H2O e Al(OH)3.
b) O2 e Al(OH)3.
c) H2 e O2.
d) H2 e Al(OH)3.
e) H2O e O2.
Letra c). Quando a substância sulfato de alumínio é dissolvida em água, temos na solução:
-
2 cátions: alumínio (Al+3), proveniente do sal, e hidrônio (H+), proveniente da água;
-
2 ânions: sulfato (SO4-2), proveniente do sal, e hidróxido (OH-), proveniente da água.
Quando a corrente elétrica chega até a cuba eletrolítica, o hidrônio sofre a descarga e forma o gás hidrogênio (H2). Isso sempre acontece quando o outro cátion é das famílias IA, IIA ou IIIA.
O hidróxido também sofre descarga, formando gás oxigênio (O2). Isso sempre ocorre quando o outro ânion apresenta oxigênio ou o fluoreto (F-).
-
-
Questão 2
Para que a eletrólise da água seja realizada, é fundamental que o cátion hidrônio (H+1) e o ânion hidróxido (OH-1), provenientes da sua autoionização, sofram a descarga elétrica de uma fonte elétrica externa, porém, para isso, os íons do eletrólito devem ser mais fracos que os provenientes da água. Baseando-se nesse fato, qual dos eletrólitos abaixo pode ser utilizado com essa finalidade?
a) Cloreto de lítio (LiCl)
b) Borato de potássio (K3BO3)
c) Carbonato de cromo III [Cr2(CO3)3]
d) Fluoreto de ferro III (FeF3)
e) Iodeto de magnésio (MgI2)
Letra b). Para que a eletrólise da água ocorra, é importante que o eletrólito dissolvido na água apresente um cátion que pertença às famílias IA, IIA e IIIA, e um ânion que possua oxigênio, ou seja, o flúor. A água disponibiliza, através da sua ionização, o cátion H+ e o ânion OH-:
Dessa forma, a resposta é a letra b, porque:
a- Apresenta o lítio que é da família IA, porém o ânion não é oxigenado, pois é o cloreto (Cl-).
b- Apresenta o potássio, que é da família IA, e o ânion oxigenado borato (BO3-3).
c- Apresenta o ânion com oxigênio, o carbonato (CO3), porém, o cátion é o cromo, que é da família VIB.
d- Apresenta o ânion fluoreto (F-), porém o cátion é o ferro, que é da família VIIIB.
e- Apresenta o magnésio, que é da família IIA, porém o ânion não é oxigenado, pois é o iodeto (I-).
-
Questão 3
(Osec-SP) O hidrogênio está sendo exaustivamente pesquisado como fonte de energia. Qual dos processos abaixo você julga mais conveniente para a obtenção dessa substância?
a) Liquefação e destilação fracionada do ar.
b) Eletrólise da água.
c) Decomposição da água oxigenada.
d) Destilação do petróleo.
e) Fermentação da cana-de-açúcar.
Letra b). Dos processos citados pelo exercício, o único que produz gás hidrogênio é a eletrólise da água. Nos outros processos, temos a produção de:
a- gás oxigênio, gás nitrogênio, etc.
c- gás oxigênio e água.
d- gasolina, óleo diesel, óleo lubrificante, etc.
e- gás carbônico.
-
Questão 4
(Mackenzie-SP) Um dos modos de se produzirem gás hidrogênio e gás oxigênio em laboratório é promover a eletrólise (decomposição pela ação da corrente elétrica) da água, na presença de sulfato de sódio ou ácido sulfúrico. Nesse processo, usando para tal um recipiente fechado, migram para o cátodo (polo negativo) e ânodo (polo positivo), respectivamente, H2 e O2. Considerando-se que as quantidades de ambos os gases são totalmente recolhidas em recipientes adequados, sob mesmas condições de temperatura e pressão, é correto afirmar que:
Dados: massas molares (g·mol–1) H = 1 e O = 16.
a) o volume de H2(g) formado, nesse processo, é maior do que o volume de O2(g).
b) serão formados 2 mols de gases para cada mol de água decomposto.
c) as massas de ambos os gases formados são iguais no final do processo.
d) o volume de H2(g) formado é o quádruplo do volume de O2(g) formado.
e) a massa de O2(g) formado é o quádruplo da massa de H2(g) formado.
Letra a). Para entender o motivo de o volume de gás hidrogênio ser maior que o de gás oxigênio, precisamos montar as seguintes equações:
-
No cátodo (redução)
Nesse polo, ocorre a redução do cátion hidrônio (H+), independentemente de utilizar o sulfato de sódio (o H+ é menos eletropositivo que o Na+) ou ácido sulfúrico (já apresenta o H+). Ao reduzir, o cátion hidrônio forma a substância simples gás hidrogênio (H2(g)). Abaixo, temos a equação balanceada desse processo:
2 H+ + 2 e→ 1 H2(g)
Há a formação de um mol de gás hidrogênio no cátodo.
-
No ânodo (oxidação)
Nesse polo, ocorre a oxidação do ânion hidróxido (OH-), independentemente de utilizar o sulfato de sódio (o OH- é menos eletronegativo que o SO4-2) ou ácido sulfúrico (já apresenta o H+), já que ambos apresentam o ânion sulfato (SO4-2), que é mais eletronegativo que o hidróxido.
Ao oxidar, o ânion hidróxido forma a substância simples gás oxigênio (O2(g)). Abaixo, temos a equação balanceada desse processo:
2 OH- → H2O(l) + 1/2O2(g)
Há a formação de meio mol de gás oxigênio no ânodo.
-