Exercícios sobre energia de ionização
A energia de ionização é a energia mínima necessária para remover um elétron de um átomo no estado gasoso em seu estado fundamental.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
A tabela abaixo apresenta três valores para a primeira energia de ionização dos átomos no estado gasoso e no estado fundamental para três elementos.
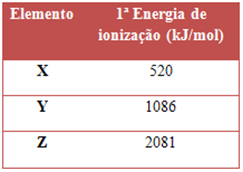
Considerando que na Tabela Periódica a energia de ionização cresce de baixo para cima e da esquerda para a direita, diga quais elementos são o X, o Y e o Z na tabela, respectivamente:
-
C, Li, Ne
-
Ne, C, Li
-
Ne, Li, C
-
Li, C, Ne
-
C, Ne, Li
Alternativa “d”.
Os três elementos em questão estão na Tabela Periódica no mesmo período (2º). Mas o Li é da família 1, o C é da família 14 e o Ne é da família 18. Visto que a energia de ionização é uma propriedade periódica que aumenta da esquerda para a direita na Tabela Periódica, isto é, cresce com o aumento da família, a ordem correta é: Li < C < Ne.
-
-
Questão 2
As energias de ionização para o carbono são representadas na tabela a seguir.
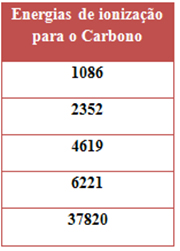
Esses valores correspondem respectivamente à:
-
1ª EI, 2ª EI, 3ª EI, 4ª EI, 5ª EI
-
5ª EI, 4ª EI, 2ª EI, 1ª EI, 3ª EI
-
5ª EI, 4ª EI, 3ª EI, 2ª EI, 1ª EI
-
1ª EI, 3ª EI, 2ª EI, 5ª EI, 4ª EI
-
1ª EI, 5ª EI, 2ª EI, 4ª EI, 3ª EI
Alternativa “a”.
A 1ª EI costuma ser a menor energia de ionização, pois como o 1º elétron é o mais afastado do núcleo, a sua força de atração com o núcleo é a menor, precisando de menos energia e sendo mais fácil removê-lo.
Além disso, com a perda de elétrons, o raio atômico diminui e o íon fica cada vez mais positivo, portanto, a atração com o núcleo fica mais forte e, consequentemente, será necessária mais energia para retirar o próximo elétron e assim sucessivamente. Por isso, temos que:
1ª EI < 2ª EI < 3ª EI < 4ª EI <<< 5ª EI
-
-
Questão 3
(Unifor-CE) “A 1ª energia de ionização é medida pela energia X quando 1 elétron é retirado de um Y isolado. Para um mesmo elemento, a 2ª energia de ionização é Z do que a 1ª.” Completa-se corretamente o texto substituindo-se X, Y e Z, respectivamente, por:
a) liberada, átomo neutro, maior.
b) absorvida, átomo neutro, maior.
c) absorvida, íon positivo, menor.
d) liberada, íon positivo, menor.
e) absorvida, íon negativo, menor.
Alternativa “b”.
-
Questão 4
(MACK-SP) Indique a alternativa na qual o átomo citado tem o maior potencial de ionização.
- He (Z = 2).
- Be (Z = 4).
- C (Z = 6).
- O (Z = 8).
- F (Z = 9).
Alternativa “a”.
Quanto menor o tamanho do átomo, maior a energia de ionização. Na Tabela Periódica, ela cresce de baixo para cima e da esquerda para a direita. Assim, o hélio, que possui apenas uma camada eletrônica, é o que possui o átomo menor, com grande atração entre seu núcleo e os elétrons dessa camada, sendo necessária uma alta energia de ionização para retirar um de seus elétrons.