Exercícios sobre a energia livre de Gibbs
Considere esta reação:
C(grafite) + 2 O2(g) → CO2(g) ΔH < 0 e ΔS < 0
Qual das afirmações propostas a seguir é a correta?
a) não é espontânea, no caso de | ΔH | > | T.ΔS |.
b) sempre é espontânea, independentemente da temperatura.
c) é espontânea apenas se | ΔH | > | T.ΔS |.
d) nunca é espontânea, independentemente da temperatura.
e) está sempre em equilíbrio, independentemente da temperatura.
Letra c). A equação fornecida pelo enunciado apresenta ΔH e ΔS negativos. A fórmula em que essas duas variáveis são utilizadas é a da energia livre de Gibbs:
ΔG = ΔH – T.ΔS
Para que o sistema seja espontâneo, o ΔG deve ser negativo. Como o ΔS é negativo, o produto modular (T.ΔS) é positivo. Assim, o valor modular do ΔH deve ser maior que o produto T.ΔS.
O óxido de cálcio pode ser obtido a partir da combustão do cálcio metálico de acordo com a equação:
Ca(s) + 1/2O2(g) → CaO(s)
Considere que a formação do óxido de cálcio é espontânea e que, para a reação acima, ΔHo = –800 kJ mol–1 e ΔSo = –240 J K–1mol–1. Determine o valor da temperatura, em Kelvin, para que essa reação deixe de ser espontânea.
a) 555,55 K
b) 222,22 K
c) 111,11 K
d) 333,33 K
e) 444,44 K
Letra d).
Dados do exercício:
-
T = ?
-
ΔHo = –800 kJ mol–1
-
ΔSo = –2400 J K–1mol–1
1o passo: converter a unidade em J para KJ do ΔS para igualar com a unidade do ΔHo.
Para tal, basta dividir o valor fornecido por 1000:
ΔSo = – 2400
1000
ΔSo = – 2,40 J K–1mol–1
2o Passo: determinação da fórmula para a energia livre de Gibbs.
A fórmula para cálculo da energia livre de Gibbs utiliza a variação da entropia, a variação da entalpia e a temperatura.
ΔG = ΔH – T.ΔS
Porém, para que a reação não seja espontânea, o ΔG deve ser maior que zero.
ΔG > 0
logo,
ΔH – T.ΔS > 0
3o Passo: substituir os valores fornecidos pelo exercício na expressão para cálculo da energia de livre de Gibbs.
ΔH - T.ΔS > 0
-800 - T.(-2,40) > 0
-800 - 2,40.T > 0
2,4.T > 800
T > 800
2,4
T > 333,33 K
(Unimontes) A energia livre de Gibbs (G) é uma grandeza termodinâmica cuja variação (ΔG) corresponde à máxima energia útil possível de ser retirada do sistema. Ela pode ser usada para prever a espontaneidade ou não do processo por meio da expressão ΔG = ΔH-T.ΔS, em que T.ΔS corresponde à energia para organizar o processo, e ΔH, à variação de entalpia. A uma mesma temperatura e pressão, têm-se os valores termodinâmicos a seguir para quatro reações químicas.
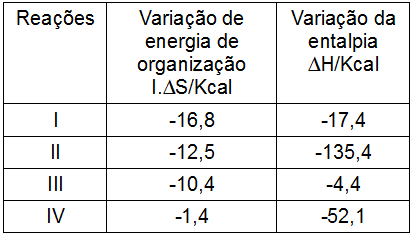
Todas as reações são espontâneas, EXCETO a
a) II.
b) IV.
c) III.
d) I.
Letra c). Analisando a tabela, a única reação em que o valor do ΔH é menor que a variação de energia de organização (T.∆S) é a III. Além disso, se jogarmos os valores fornecidos da reação III na fórmula do ΔG, teremos um resultado positivo, o que caracteriza um processo não espontâneo:
ΔG = ΔH - T.ΔS
ΔG = -4,4 - (-10,4)
ΔG = -4,4 + 10,4
ΔG = + 6 Kcal
(UECE) Josiah Willard Gibbs (1839 – 1903) foi um pesquisador norte-americano que contribuiu para a determinação da energia livre de um sistema termodinâmico por meio de uma lei que é associada ao seu nome. Em se tratando de energia livre e de entropia, analise as seguintes proposições:
I. A energia livre pode ser positiva ou negativa, mas nunca pode ser nula.
II. A energia livre é a totalidade de energia de um sistema termodinâmico e pode ser usada para a realização de trabalho útil.
III. Toda a reação exotérmica é espontânea.
IV. A variação de entropia de uma reação espontânea pode ser negativa.
V. Em certas reações químicas, a variação de entalpia coincide com a variação da energia interna.
É correto o que se afirma somente em:
a) I e II.
b) III e IV.
c) I, III e V.
d) II, IV e V.
Letra d). Alguns itens estão incorretos porque:
I- Como o ΔG é o resultado da variação entre o ΔH e o produto T.ΔS, pode ser que o resultado seja nulo;
III- Para que a reação exotérmica seja espontânea, é necessário que a variação da entropia do sistema seja positiva, independentemente da temperatura, o que nem sempre acontece.






