Exercícios sobre força intermolecular dipolo permanente
As forças de dipolo permanente são características de moléculas polares. Elas são mais intensas que as de dipolo induzido e mais fracas que as ligações de hidrogênio.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Qual alternativa contém somente substâncias que possuem a força dipolo-dipolo entre suas moléculas?
a) H2S, CO, HCCl3, SO2.
b) H2S, N2, C6H6, C4H9OH, Hg.
c) CO, H2O, CH4, C3H8.
d) HCCl3, CCl4, NH3, HCl.
e) SO2, HBr, HCl, H2O.
Alternativa “a”.
É a única alternativa em que todas as substâncias são polares.
-
Questão 2
Considere o clorometano (CH3Cl) e o iodometano (CH3I).
a) Represente suas formas geométricas e classifique essas substâncias como polares ou apolares.
b) Que tipo de interação molecular mantém as moléculas unidas no estado líquido?
c) Sabendo-se que as temperaturas de ebulição do CH3Cl e do CH3I são 24,0 ºC e 42,4 °C, respectivamente, indique que composto apresenta, na fase líquida, forças intermoleculares mais intensas.
a)
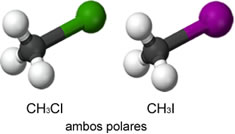
b) Interações dipolo-dipolo em ambas as substâncias.
c) O CH3I apresenta forças intermoleculares mais intensas, pois possui maior ponto de ebulição. As forças de dispersão de London do CH3I são maiores que no CH3Cl devido à maior superfície de contato entre as moléculas do primeiro. Além disso, no CH3I, a polarizabilidade é maior.
-
Questão 3
(Ceeteps-SP) Para os compostos HF e HCl, as forças de atração entre as moléculas ocorrem por:
a)ligações de hidrogênio para ambos.
b) dipolo-dipolo para ambos.
c) ligações de Van der Walls para o HF e ligações de hidrogênios para HCl.
d) ligações de hidrogênio para o HF e dipolo-dipolo para o HCl.
e) ligação eletrostática para HF e dipolo induzido para HCl.Alternativa “d”.
-
Questão 4
(FEI-SP) Qual o tipo de interação que se manifesta entre moléculas de:
a) HI(ℓ)?
b) NH3(ℓ)?
c) CH4(ℓ)?
a) HI(ℓ) = forças de dipolo permanente
b) NH3(ℓ) = ligações de hidrogênio
c) CH4(ℓ) = forças de dipolo induzido