Exercícios sobre forças intermoleculares e ponto de ebulição das substâncias
Estes exercícios sobre as forças intermoleculares e o ponto de ebulição das substâncias abordam a influência dessas forças nessa importante propriedade da matéria.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Dadas as substâncias abaixo:
I. Ácido clorídrico (HI)
II. Gás carbônico (CO2)
III. Amônia (NH3)
IV. Gás flúor (F2)
V. Ácido sulfídrico (H2S)
Assinale a opção que contém a ordem crescente correta para as suas temperaturas de ebulição.
a) I < IV < III < II < V
b) IV < II < V < I < III
c) IV < II < I < V < III
d) III < I < II < V < IV
e) IV < V < II < I < III
Letra b). Para justificar a ordem crescente do ponto de ebulição dessas substâncias, é preciso comparar o tipo de força intermolecular apresentado por cada uma delas, já que quanto maior é a intensidade da força (ligação de hidrogênio > dipolo permanente > dipolo induzido), maior é o ponto de ebulição.
Obs.: Caso as moléculas apresentem o mesmo tipo de força intermolecular, possui maior ponto de ebulição aquela que apresenta maior massa.
I- É uma substância polar, logo, suas moléculas interagem por dipolo permanente. Sua massa molar é 128 g/mol.
II- É uma substância apolar, logo, suas moléculas interagem por dipolo induzido. Sua massa molar é 44 g/mol.
III- Suas moléculas interagem por ligações de hidrogênio, já que apresenta hidrogênio ligado a nitrogênio.
IV- É uma substância apolar, logo, suas moléculas interagem por dipolo induzido. Sua massa molar é 38 g/mol.
V- É uma substância polar, logo, suas moléculas interagem por dipolo permanente. Sua massa molar é 34 g/mol.
-
Questão 2
Observe a seguinte tabela com o ponto de ebulição (em graus Celsius) de alguns ácidos inorgânicos:
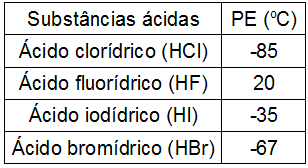
O comportamento do HF, bastante diferente dos demais compostos, justifica-se porque entre suas moléculas ocorrem:
a) ligações covalentes apolares.
b) ligações covalentes polares.
c) interações denominadas ligações de hidrogênio.
d) interações dipolo-induzido.
e) interações por dipolo permanente.
Letra c). O ponto de ebulição do HF é muito diferente em relação às outras substâncias, apesar de todas elas serem polares. Isso porque apenas essa substância realiza entre suas moléculas as forças intermoleculares mais intensas existentes, denominadas ligações de hidrogênio.
Obs.: Ligações de hidrogênio são características de moléculas que apresentam o elemento hidrogênio ligado a nitrogênio, oxigênio ou flúor.
-
Questão 3
(ITA-SP) Sobre a temperatura de ebulição de um líquido, são feitas as seguintes afirmações:
I. Aumenta com o aumento da força da ligação química intramolecular.
II. Aumenta com o aumento da força da ligação química intermolecular.
III. Aumenta com o aumento da pressão exercida sobre o líquido.
IV. Aumenta com o aumento da quantidade de sólido dissolvido.
Estão corretas:
a) Apenas I e II.
b) Apenas I e IV.
c) Apenas III e IV.
d) Apenas II, III e IV.
e) Todas.
Letra d).
I- Falso.
II- Verdadeiro. Para um líquido entrar em ebulição, é necessário separar suas moléculas. Assim, quanto maiores as forças intermoleculares, maior será a influência sobre o ponto de ebulição.
III- Verdadeiro. Quanto maior a pressão exercida sobre um líquido, maior é o seu ponto de ebulição, já que a vaporização torna-se mais difícil.
IV- A dissolução de um soluto (sólido ou líquido) em um solvente sempre dificulta a vaporização do solvente, o que promove, assim, um aumento do seu ponto de ebulição.
-
Questão 4
(Unificado-RJ) Observe a tabela de pontos de ebulição:

O ponto de ebulição da água é anômalo em relação aos demais compostos da família do oxigênio, porque:
a) as moléculas da água são mais leves.
b) existem pontes de hidrogênio entre as moléculas da água.
c) existem Forças de Van der Waals entre as moléculas da água.
d) somente a molécula da água é apolar.
e) as demais substâncias decompõem-se termicamente.
Letra b). O ponto de ebulição da água é muito diferente em relação às outras substâncias, apesar de todas elas serem polares. Isso porque apenas a água realiza entre suas moléculas as forças intermoleculares mais intensas existentes, denominadas ligações de hidrogênio.