Exercícios sobre fórmulas das ligações iônicas
As duas principais fórmulas das ligações iônicas são a fórmula unitária e a fórmula eletrônica de Lewis
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Um elemento X possui número atômico 12 e se combina com um elemento Y, que está situado na família 15 da tabela periódica. Qual será a fórmula unitária mais provável desse composto iônico?
a) XY
b) XY2
c) X2Y
d) X2Y3
e) X3Y2
Alternativa “e”.
- Primeiro fazemos a distribuição eletrônica do elemento X para descobrir qual será o íon que ele forma:
12X: 1s2 2s2 2p6 3s2: forma cátion bivalente X2+.
Visto que o elemento Y é da família 15, isso significa que ele possui 5 elétrons em sua última camada eletrônica. Portanto, ele forma o ânion trivalente Y3-.
- Agora realizamos a fórmula iônica: X2+ Y3- → X3Y2
-
Questão 2
O alumínio é um dos elementos mais abundantes na natureza. Pode se apresentar, por exemplo, na forma de:
- Bauxita: mineral rico em óxido de alumínio (substância formada por alumínio e oxigênio).
- Criolita: mineral com teor significativo de fluoreto de alumínio e sódio – Na3AlFx.
- Alúmen: mineral rico em sulfato de alumínio e potássio – KAl(SO4)2 – ou sulfato de alumínio e sódio encontrado normalmente nas rochas e conhecido como pedra-ume.
a) Usando a Tabela Periódica, indique a fórmula do alúmen de sódio.
b) Determine o valor de x na fórmula do fluoreto de alumínio e sódio.
a) NaAl (SO4)2. Sódio (Na) é da mesma família do potássio (K), consequentemente, ambos têm a mesma carga (+1) e ocupam a mesma posição de cátion na fórmula unitária.
b) 6
+1 +3 -1
Na3 Al Fx3. (+1) + 1 . (+3) + x . (-1) = 0
3 + 3 – x = 0
x = 6 -
Questão 3
(UFV-MG) Os compostos formados pelos pares Mg e Cl; Ca e O; Li e O; K e Br possuem fórmulas cujas proporções entre os cátions e os ânions são, respectivamente:
Dados: Li (Z=3); O (Z=8); Mg (Z=12); Cℓ (Z=17); K (Z=19); Ca (Z=20); Br (Z=35)
a) 1 : 1 2 : 2 1 : 1 1 : 2
b) 1 : 2 1 : 2 1 : 1 1 : 1
c) 1 : 1 1 : 2 2 : 1 2 : 1
d) 1 : 2 1 : 1 2 : 1 1 : 1
e) 2 : 2 1 : 1 2 : 1 1 : 1
Alternativa “d”.
Mg e Cl → Mg2+ Cl- → MgCl2 → 1:212Mg: 1s2 2s2 2p6 3s2: forma cátion bivalente Mg2+
17Cl: 1s2 2s2 2p6 3s2 3p5: forma ânion monovalente Cl-Ca e O → Ca2+ O2- → CaO → 1:1
20Ca: 1s2 2s2 2p6 3s2 3p6 4s2: forma cátion bivalente Ca2+
8O: 1s2 2s2 2p4: forma ânion bivalente O2-Li e O → Li+ O2- → Li2O → 2:1
3Li: 1s2 2s1: forma cátion monovalente Li+
8O: 1s2 2s2 2p4: forma ânion bivalente O2-K e Br → K+ Br- → KBr → 1:1
19K: 1s2 2s2 2p6 3s2 3p6 4s1: forma cátion monovalente K+
35Br: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5: forma ânion monovalente Br- -
Questão 4
(MACK-SP)
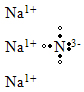 representa uma substância:
representa uma substância:a) Iônica, de fórmula NaN3
b) Molecular, de fórmula NaN
c) Molecular, de fórmula N2Na3
d) Iônica, de fórmula Na3N
e) Iônica, de fórmula Na3N3
Alternativa “d”.