Exercícios sobre lei da velocidade das reações
Estes exercícios sobre lei da velocidade das reações envolvem o fato de que a concentração é proporcional à velocidade. Isso pode ser expressado por meio de uma equação.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(Uni-Rio-RJ) Num laboratório, foram efetuadas diversas experiências para a reação:
2 H2(g) + 2 NO(g) → N2(g) + 2 H2O(g)
Com os resultados das velocidades iniciais obtidos, montou-se a seguinte tabela:
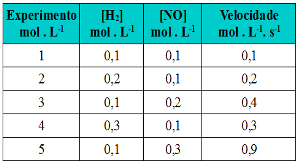
Dados obtidos em experimento sobre a lei da velocidadeBaseando-se na tabela acima, podemos afirmar que a lei de velocidade para a reação é:
a) V = k. [H2]
b) V = k. [NO]
c) V = k. [H2] . [NO]
d) V = k. [H2]2 . [NO]
e) V = k. [H2] . [NO]2Alternativa “e”.
V = k. [H2]α . [NO]β
Mantendo-se [NO] constante e dobrando-se [H2] (experimento 2), a taxa de desenvolvimento dobra. Logo α = 1 .
Mantendo-se [H2] constante e dobrando-se [NO] (experimento 3), a taxa de desenvolvimento quadruplica. Logo β = 2.
Desse modo, concluimos que a lei da velocidade dessa reação é: V = k. [H2] . [NO]2 .
-
Questão 2
(Efei-MG) A cinética da reação hipotética:
2 A + 3 B → 1 D + 2 C
foi estudada, obtendo-se a seguinte tabela:
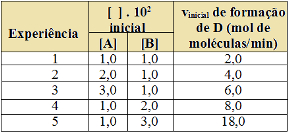
Exercícios sobre lei da velocidade das reações químicasA lei da velocidade para a reação hipotética é fornecida pela equação:
a) v = k . [A]2 . [B]3 b) v = k . [A]2 . [B]2
c) v = k . [A]2 . [B] d) v = k . [A] . [B]2
e) v = k . [A]
Alternativa “d”.
De acordo com os dados fornecidos, dobrando-se a concentração em quantidade de matéria de A, a velocidade da reação dobra. Por outro lado, dobrando-se a concentração em quantidade de matéria de B, a velocidade da reação quadruplica. Logo a expressão da velocidade da reação é: V = k . [A] . [B]2.
-
Questão 3
Considere a seguinte reação a 55ºC:
(CH3)3CBr(aq) + OH-(aq) → (CH3)3COH(aq) + Br-(aq)
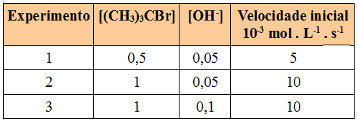
Experimentos sobre lei de ação das massas ou lei de velocidade das reaçõesDetermine a equação da rapidez ou lei da velocidade dessa reação a 55ºC:
a) V = k. [(CH3)3CBr]
b) V = k. [OH-]
c) V = k. [(CH3)3CBr] . [OH-]
d) V = k. [(CH3)3CBr]2 . [OH-]
e) V = k. [(CH3)3CBr] . [OH-]2Alternativa “a”.
De acordo com os dados fornecidos, dobrando-se (experimentos 1 e 2) a concentração em quantidade de matéria de [(CH3)3CBr], a velocidade da reação dobra, logo seu expoente é igual a 1. Por outro lado, dobrando-se a concentração em quantidade de matéria de [OH-] (experimentos 2 e 3), a velocidade da reação não é alterada. Logo a expressão da velocidade da reação é: V = k. [(CH3)3CBr] . [OH-]0. Mas todo número elevado a zero é igual a 1. Por isso, temos:
V = k. [(CH3)3CBr] . 1
V = k. [(CH3)3CBr]
-
Questão 4
Considere a seguinte reação química hipotética:
A(g) + 2 B(g) → AB2(g)
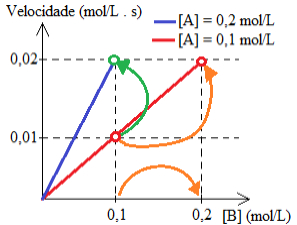
Com os dados obtidos, construiu-se o seguinte gráfico, em que foi medida a velocidade inicial da reação, variando-se as concentrações de A e B.
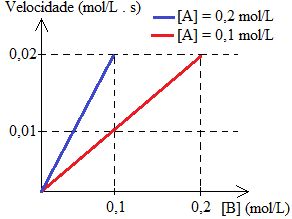
Gráfico com velocidade inicial de reação genéricaDetermine a lei da velocidade dessa reação genérica:
a) v = k . [A]2 . [B]3 b) v = k . [A]2 . [B]2
c) v = k . [A]2 . [B] d) v = k . [A] . [B]
e) v = k . [A]
Alternativa “d”.
V = k. [A]α . [B]β
De acordo com os dados fornecidos no gráfico, a velocidade da reação dobra quando a concentração de B dobra e a de A é mantida constante (seta laranja abaixo). Logo, α = 1 . A velocidade da reação também dobra quando a concentração de A é dobrada (seta verde). Portanto, β = 1 .
Então, conclui-se que a lei da velocidade da reação é: v = k . [A] . [B].
Resolução de exercício sobre lei da velocidade das reações