Exercícios sobre Ligação Covalente
A ligação covalente ocorre por meio do compartilhamento de elétrons entre ametais, semimetais e hidrogênio.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Qual das alternativas a seguir apresenta substâncias formadas somente por meio de ligações covalentes?
-
K2SO4, CO, CO2, Na2O
-
Si, Cgrafita, P4, N2, Zn
-
NaCl, AsCl3, CCl4, TiCl4
-
H2SO4, HNO3, PCl5
Alternativa “d”.
Nas outras alternativas, as substâncias que apresentam somente ligações covalentes são:
a) CO e o CO2.
b) Si, Cgrafita, P4 e N2.
c) AsCl3 e o CCl4.
-
-
Questão 2
Um elemento X possui número atômico igual a 1 e outro elemento Y possui número 17. Qual será a fórmula molecular formada pela ligação covalente entre esses dois elementos?
-
X2Y
-
XY
-
XY2
-
YX
-
X2Y2
Alternativa “b”.
O elemento X possui apenas um elétron, portanto, ele é o hidrogênio, que precisa receber mais um elétron para ficar estável. Já o elemento Y é o cloro, que possui 17 elétrons, sendo que na última camada eletrônica ficam 7 elétrons, dessa forma, ele também precisa receber mais um elétron, ficando estável com oito elétrons na camada de valência.
Desse modo, eles compartilham apenas um par de elétrons e ambos ficam estáveis:
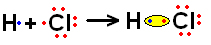
A fórmula molecular é HCl. Usando os símbolos dados no enunciado do exercício temos: XY.
-
-
Questão 3
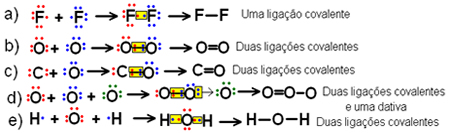
(Mackenzie-SP) Dados: O (Z=8); C (Z=6); F (Z=9); H (Z=1). A molécula que apresenta somente uma ligação covalente normal é:
- F2
- O2
- CO
- O3
- H2O
Alternativa “a”.
-
Questão 4
(FCMSC-SP) Qual das fórmulas abaixo é prevista para o composto formado por átomos de fósforo (Z = 15) e flúor (Z = 9), considerando o número de elétrons da camada de valência de cada átomo?
a) P ≡ F
b) P ─ F ≡ P
c) F ─ P ≡ F
d) F ─ P ─ F
│
F
e) P ─ F ─ P
│
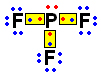
PAlternativa “d”.
O número atômico do fósforo é 15, sendo que seus elétrons estão distribuídos em três camadas eletrônicas da seguinte forma: 2 – 8 – 5. Visto que possui 5 elétrons na última camada, ele precisa ganhar três elétrons para ficar estável, segundo a Regra do Octeto. Já cada átomo de flúor possui 9 elétrons distribuídos em duas camadas: 2 – 7. Com sete elétrons na última camada, cada flúor só pode receber um elétron. Assim, serão necessários três átomos de flúor para estabilizar um átomo de fósforo: