Exercícios sobre a ligação pi
Estes exercícios sobre a ligação pi apresentam situações em que esse tipo de ligação covalente pode aparecer nas mais diversas estruturas.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
A tosse pode ser combatida por meio da utilização de um composto orgânico denominado pentoxiverina, cuja fórmula estrutural está representada a seguir:
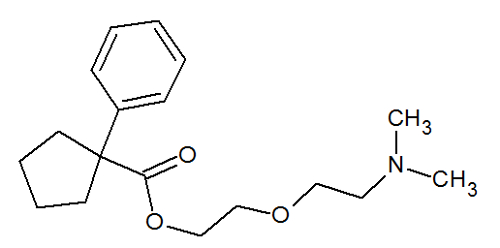
Analisando a fórmula estrutural desse importante princípio ativo, podemos afirmar que nela existem quantas ligações pi?
a) 1
b) 2
c) 3
d) 4
e) 5
Letra d). As ligações pi estão presentes apenas nas ligações duplas (uma ligação é pi e a outra, sigma) e triplas (duas ligações pi e uma sigma). Assim, como na estrutura da pentoxiverina existem quatro ligações duplas, logo, existem quatro ligações pi.
-
Questão 2
O etino é um alcino de baixa massa molar que se apresenta no ambiente no estado gasoso por causa de seu baixo ponto de ebulição. Sua fórmula estrutural pode ser representada de forma esquemática, como da seguinte maneira:
Sobre essa molécula, podemos afirmar que:
a) Possui uma ligação pi e três ligações sigma.
b) Possui duas ligações pi.
c) Possui duas ligações sigma.
d) Possui três ligações pi e uma ligação sigma.
Letra b). Analisando a representação, no etino, cada átomo de carbono está ligado a apenas um átomo de hidrogênio, os quais realizam apenas ligações simples, ou seja, sigma.
Como o carbono necessita realizar quatro ligações (e efetua uma com o hidrogênio), nos carbonos, portanto, existe a presença de uma ligação tripla, a qual é formada por uma ligação sigma e duas ligações pi.
-
Questão 3
(UFV) No hidrocarboneto de fórmula estrutural representada a seguir, os átomos de carbono estão numerados de 1 a 7.
.jpg)
Sobre esse hidrocarboneto, são feitas as seguintes afirmativas:
I. O total de ligações π (pi) na estrutura é igual a três.
II. O átomo de carbono dois forma três ligações π (pi) e uma ligação σ (sigma).
III. O átomo de carbono cinco forma três ligações σ (sigma) e uma ligação π (pi).
IV. O átomo de carbono um forma quatro ligações σ (sigma).
São corretas apenas as afirmativas:
a) I, III e IV.
b) II e IV.
c) I e II.
d) I, II e IV.
Letra a). A seguir, justificamos cada um dos itens propostos pelo exercício:
I- Verdadeiro. A estrutura apresenta três ligações do tipo pi: uma na ligação dupla entre os carbonos de número cinco e seis; e duas na ligação tripla entre os carbonos de número dois e três.II- Falso. O átomo do carbono de número três não pode apresentar três ligações pi e uma sigma porque nele há uma ligação tripla (formada por duas pi e uma sigma) e uma ligação simples (que é uma sigma).
III- Verdadeiro. O carbono de número cinco possui três ligações sigma e uma pi porque realiza duas ligações simples (que são sigma) e uma dupla (formada por uma sigma e uma pi).
IV- Verdadeiro. O carbono de número um possui quatro ligações sigma, pois apresenta quatro ligações simples.
-
Questão 4
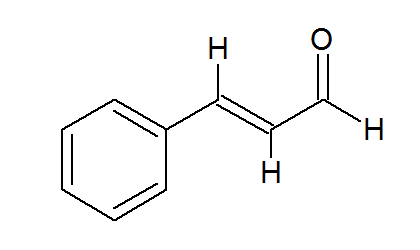
(PUC-MG) A substância responsável pelo odor característico da canela (Cinnamomum zeulanicum) tem nome usual de aldeído cinâmico.
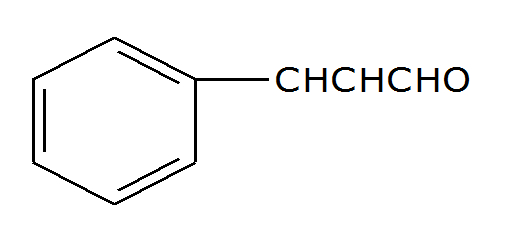
Qual o número de ligações pi presentes nesse composto:
a) 1
b) 2
c) 3
d) 5
Letra d). Analisando a estrutura desse composto, verificamos a presença de três ligações pi, pois são visíveis as três ligações duplas no anel, formadas por uma ligação sigma e uma pi.
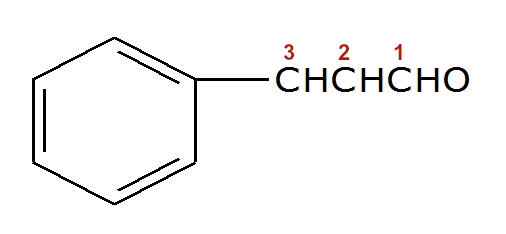
Porém, podemos observar que, no carbono de número um, o oxigênio está à direita do hidrogênio, o que significa que ele e o hidrogênio estão ligados ao carbono simultaneamente. Como o oxigênio deve realizar duas ligações, portanto, existe uma ligação dupla entre ele e o carbono.
Outra observação importante é que os carbonos dois e três estão com apenas um hidrogênio, logo, entre eles, há uma ligação dupla para fechar as quatro ligações que um carbono deve realizar.