Exercícios sobre números quânticos
Os números quânticos são códigos matemáticos associados à energia do elétron. São quatro os números quânticos: principal (n), secundário (ℓ), magnético (m) e spin.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Coloque no esquema abaixo, que representa determinado subnível, um total de 7 elétrons:
.jpg)
Indique os quatro números quânticos do último elétron colocado, sabendo que esse subnível é da camada M.
n = 3; ℓ= 2; m = -1;s = +1/2.
Visto que é da camada M (3º nível de energia), seu número principal será → n = 3.
A representação é do subnível d, pois possui 5 orbitais (representados pelos quadrados), portanto, seu número secundário é → ℓ= 2.
A ordem de colocação dos sete elétrons no subnível obedece à regra de Hund (os números escritos na figura abaixo indicam a ordem de “entrada” dos elétrons):
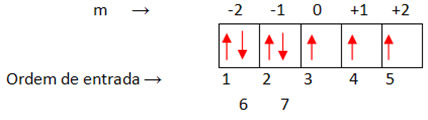
Portanto, o último elétron possui número quântico magnético igual a →m = -1;
Como a seta está para baixo, e pela convenção feita, o número quântico do spin é →s = +1/2.
-
Questão 2
Indique quais são os números quânticos que representam o elétron assinalado abaixo e que está situado no subnível 4f.

Número quântico principal: n = 4
Número quântico secundário:ℓ = 3
Número quântico magnético: m = -3
Número quântico de spin: s = -1/2
-
Questão 3
Indique qual é o conjunto dos quatro números quânticos do elétron mais energético do átomo do elemento Ferro (Z = 26).
n = 3; ℓ= 2; m = -2;s = +1/2.
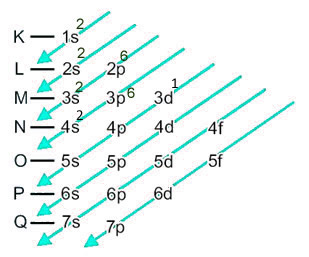
Primeiramente realizamos a sua distribuição eletrônica no diagrama de Pauling:
.jpg)
O último subnível preenchido foi o 3d; portanto, ele possui o número quântico principal igual a n = 3 e o secundário é ℓ = 2. Para descobrir o número quântico magnético e o do spin é preciso fazer a representação gráfica abaixo:
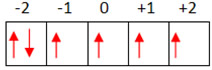
Com isso, o número quântico magnético é m = -2e o do spin é s = +1/2.
-
Questão 4
(Ufac) Um elétron localiza-se na camada “2” e subnível “p” quando apresenta os seguintes valores de números quânticos:
a) n = 4 e ℓ= 0
b) n = 2 e ℓ= 1
c) n = 2 e ℓ= 2
d) n = 3 e ℓ= 1
e) n = 2 e ℓ= 0
Alternativa “b”
-
Questão 5
(UECE) Considere três átomos A, B e C. Os átomos A e C são isótopos, B e C são isóbaros e A e B sãoisótonos. Sabendo-se que A tem 20 prótons e número de massa 41 e que o átomo C tem 22 nêutrons, os números quânticos do elétron mais energético do átomo B são:
a) n = 3; ℓ = 0, mℓ= 2; s = -1/2
b) n = 3; ℓ = 2, mℓ= -2; s = -1/2
c) n = 3; ℓ = 2, mℓ= 0; s = -1/2
d) n = 3; ℓ = 2, mℓ= -1; s = 1/2
e) n = 4; ℓ = 0, mℓ= 0; s = -1/2
Alternativa “b”
Se A tem 20 prótons, C também tem, pois eles são isótopos. Além disso, A tem número de massa 41:
2041A B 20C
Se C tem 22 nêutrons, então seu número de massa será igual a 22 + 20 = 42:
2041A B 2042C
Se B e C são isóbaros, quer dizer que seus números de massa são iguais:
2041A 42B 2042C
A e B são isótonos, o que significa que possuem a mesma quantidade de nêutrons. Levando em conta que a quantidade de nêutrons do átomo A é 41 -20 = 21 e, que, portanto, B também possui 21 nêutrons, podemos descobrir a quantidade de prótons do B:
42 – 21 = 21 → 2041A 2142B 2042C
Assim, o número atômico de B é 21. Com essa informação, podemos fazer a distribuição eletrônica de B e responder a questão:
O elétron mais energético está na camada M (3ª), por isso o número quântico principal é n = 3. O último subnível preenchido foi o d, assim, o número quântico secundário é ℓ = 2.
Para descobrir os outros números quânticos, fazemos a representação:
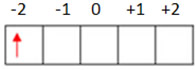
Assim, o número quântico magnético é m = -2; e o do spin é s = -1/2.
-
Questão 6
(UFPI) Indique a alternativa que representa um conjunto de números quânticos permitido:
a) n = 3; ℓ = 0, m= 1; s = +1/2
b) n = 3; ℓ = 4, m= 1; s = +1/2
c) n = 3; ℓ = 3, m= 0; s = +1/2
d) n = 3; ℓ = 2, m= 1; s = +1/2
e) n = 4; ℓ = 0, m= 3; s = -1/2
Alternativa “d”
a) Não pode ser, porque se n = 3 e ℓ = 0 isso significa que o elétron em questão está no subnível 3s, portanto o único valor possível para m é 0, e não 1.
b) O valor máximo permitido para o ℓ é 3, não existe ℓ = 4.
c) Se n = 3 e ℓ = 3, isso quer dizer que o subnível teria que ser 3 f, e esse subnível não existe.
d) Correta.
e) Se n = 4 e ℓ = 0, então o subnível é o 4s, e o único valor para m seria 0, e não pode ser 3.