Exercícios sobre os elementos radioativos
Esta lista de exercícios sobre os elementos radioativos aborda as características, bem como sua localização na tabela periódica.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
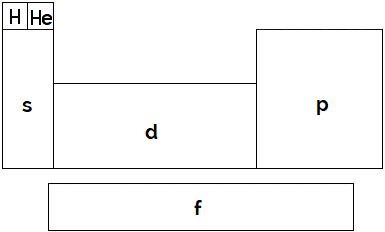
O esquema a seguir apresenta a tabela periódica separada pela localização do elétron de maior energia nos orbitais dos subníveis s, p, d e f:
Com relação aos elementos posicionados no bloco f, especificamente, são feitas as seguintes observações:
I- Os elementos posicionados no bloco f apresentam número atômico maior que 88.
II- Alguns elementos posicionados no agrupamento f podem ser classificados como elementos radioativos.
III- Os elementos posicionados no bloco f são denominados transurânicos.
Destas, está (ão) correta (s):
a) I apenas.
b) II apenas.
c) IIII apenas.
d) I e III apenas.
e) I, II e III.
Letra B
I- Falso. No bloco f, temos as séries dos lantanídeos, com elementos cujo número atômico varia de 57 a 70, e a série dos actenídeos, com elementos cujo número atômico varia de 89 a 102.
II- Verdadeiro. Todos os elementos da série dos actinídeos são radioativos (têm número atômico maior que 84), e a série dos lantanídeos não.
III- Falso. No bloco f, apenas na série dos lantanídeos existem alguns elementos químicos com número atômico maior que 92 (transurânicos).
-
Questão 2
A distribuição eletrônica de um átomo Y, no estado neutro, apresenta o subnível mais energético 5f2. Com relação a esse átomo, pode-se afirmar que ele:
I. apresenta dois elétrons na camada de valência.
II. pertence à família periódica IIIA.
III. pertence à família periódica IIIB, localizado no 7o período.
IV. é um elemento radioativo.
V. possui número atômico 88.
a) I e II estão corretas.
b) I, II e V estão corretas.
c) I, III e IV estão corretas.
d) III, IV e V estão corretas.
e) todas estão corretas.
Letra C
Inicialmente, é interessante realizar a distribuição eletrônica até o subnível proposto (5f2):
I- Verdadeiro. A camada de valência do átomo é sempre a mais distante do núcleo. No caso do elemento Y, é a 7a, na qual existem dois elétrons.
II- Falso. Como o elemento apresenta número atômico 90, não existe nenhum elemento na família IIIA com esse número atômico, e sim 5, 13, 31, 49, 81, 113.
III- Verdadeiro. Como o elemento apresenta número atômico igual a 90, ele é o elemento Tório, localizado na série dos actinídeos, a qual pertence à família IIIB.
IV- Verdadeiro. Todo elemento com número atômico maior que 84 é radioativo.
V- Falso. Ao somar os elétrons presentes na distribuição acima, verificamos que o número atômico utilizado foi igual a 90.
-
Questão 3
(UFU-MG-Adaptada) Leia a seguir o anúncio da descoberta dos novos elementos:
"Welcome to the International Union of Pure and Applied Chemistry
Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118
IUPAC announces the verification of the discoveries of four new chemical elements: The 7th period of the periodic table of elements is complete."Foi assim que, em 30 de dezembro de 2015, a IUPAC (sigla, em inglês, de International Union of Pure and Applied Chemistry) anunciou, formalmente, a inclusão de novos elementos na Tabela Periódica: Unúntrio (113Uut), Unumpêntio (115Uup), Ununséptio (117Uus) e Ununóctio (118Uuo). Esses novos elementos transurânicos possuem grandes núcleos e são:
a) naturais e de peso atômico elevado.
b) artificiais e altamente radioativos.
c) isoeletrônicos e isótopos entre si.
d) estáveis com semelhança no tempo de vida.
Letra B
a- Falso. Na natureza, só existem elementos químicos cujo número atômico é, no máximo, igual a 92.
b- Verdadeiro. Esses elementos não existem na natureza (são artificiais) e, por apresentarem número atômico maior que 84, são elementos radioativos.
c- Falso. Seriam isótopos e isoeletrônicos se o número atômico deles fosse o mesmo.
d- Falso. Como são elementos radioativos, são instáveis.
-
Questão 4
(Uece) Atente para a seguinte manchete da Folha de São Paulo em 06.12.2006: “Morte de ex-espião russo torna polônio 210 conhecido no mundo”. Segundo o periódico, Alexander Litvinenko foi envenenado com uma dose da substância, descoberta pelo casal Curie, ministrada junto com o chá por ele ingerido. Apesar de ser raro, o polônio é encontrado no cigarro e emite radiações α (alfa). Sobre o polônio, assinale com V (verdadeira) ou F (falsa) as afirmações abaixo.
( ) Sua distribuição eletrônica é [Kr] 4f14 5d10 6s2 6p4.
( ) Trata-se de um elemento transurânico.
( ) Sua radiação pode ser detida por uma folha de papel.
( ) Só é letal quando ingerido ou inalado.
( ) É mais eletronegativo do que o selênio e o telúrio.
A sequência correta, de cima para baixo, é:
a) V, F, F, F, V.
b) F, V, V, F, V.
c) F, F, V, V, F.
d) F, V, V, F, F.
Letra C
Item I- Falso. Quando realizamos a distribuição eletrônica utilizando o número atômico do polônio, que é 84, verificamos que os últimos subníveis preenchidos são 4f14 5d10 6s2 6p4. O elemento polônio está no mesmo período que o radônio (Rn) e não do criptônio (Kr).
Item II- Falso. Os elementos transurânicos são todos os elementos radioativos com número atômico maior que 92, e o número atômico do polônio é 84.
Item III- Verdadeiro. A radiação alfa apresenta um baixo poder de penetração.
Item IV- Verdadeiro. Sua radiação apresenta um baixo poder de penetração e alto poder de absorção. Para gerar dano, é necessário uma dose muito elevada de exposição.
Item V- Falso. Por apresentar um raio atômico maior que o selênio e o telúrio, automaticamente, será menos eletronegativo, já que são propriedades periódicas inversamente proporcionais.