Exercícios sobre Polaridade das Moléculas
A polaridade das moléculas pode ser determinada por meio do momento dipolar ou da comparação do número de nuvens eletrônicas e os ligantes do elemento central.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Qual dentre as moléculas abaixo é apolar?
-
H2O
-
HCℓ
-
BCℓ3
-
CH3Cℓ
-
NH3
Alternativa “c”.
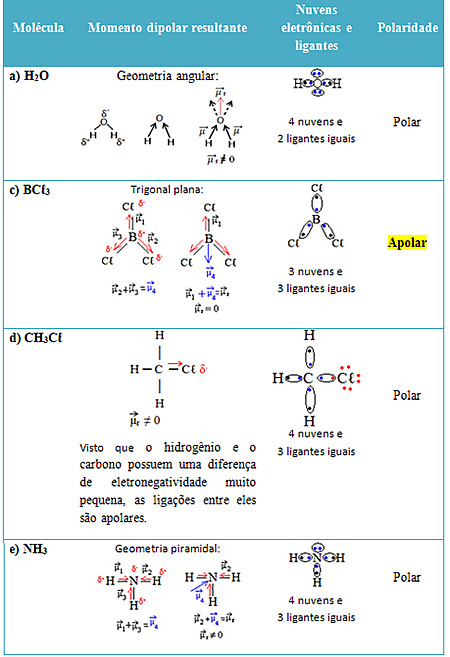
No caso da letra b, podemos facilmente ver que o HCℓ é polar, porque o cloro é mais eletronegativo que o hidrogênio, atraindo os elétrons. Mas as outras moléculas possuem três ou mais átomos e, nesses casos, podemos identificar a polaridade das moléculas de duas maneiras:
1ª) Analisando o vetor momento dipolar resultante (se der igual a zero é apolar, se der diferente de zero é polar);
2ª) Comparando o número de nuvens eletrônicas ao redor do átomo central com o número de grupos iguais ligados a ele (se der igual à molécula é apolar, se der diferente, ela é polar).
Veja os dois casos para cada uma das alternativas:
-
-
Questão 2
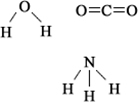
Analise a geometria das moléculas representadas a seguir e classifique as afirmações como verdadeiras ou falsas.
-
A molécula de CO2 é apolar, pois ligações duplas são apolares.
-
Os compostos NH3 e H2O apresentam moléculas polares.
-
A molécula do composto CO2 é apolar, pois o vetor momento dipolar resultante é igual a zero.
-
A molécula de H2O é polar, pois é angular e o átomo de O é mais eletronegativo que o de H.
-
A molécula de NH3 é apolar, pois apresenta ligações simples iguais.
-
Falsa. O oxigênio é mais eletronegativo que o carbono, assim, cada ligação que eles realizam é polar, independentemente se a ligação é simples, dupla ou tripla. No entanto, como são duas ligações com intensidades iguais, mas em sentidos contrários, uma anula a outra e a molécula é apolar. Além disso, se analisarmos as nuvens eletrônicas do átomo central, que é o carbono, veremos que ele tem duas, que é a mesma quantidade de átomos iguais (oxigênios), ligadas a ele. Isso confirma que o CO2 é realmente apolar.
-
Verdadeira.
-
Verdadeira.
-
Verdadeira.
-
Falsa. A molécula de NH3 é polar, pois o nitrogênio é mais eletronegativo que os hidrogênios, e como são três ligações em sentidos diferentes, o momento dipolar resultante é diferente de zero. Além disso, o nitrogênio possui quatro nuvens eletrônicas e três ligantes iguais, confirmando que essa molécula é realmente polar.
-
-
Questão 3
(PUC-PR) Observe as moléculas a seguir: NH3, CHCℓ3, SO3. Suas geometrias moleculares e polaridades são, respectivamente:
-
tetraédrica/polar; tetraédrica/polar; trigonal plana/polar.
-
piramidal/ polar; tetraédrica/polar; trigonal plana/apolar.
-
trigonal plana/apolar; angular/polar; tetraédrica/apolar.
-
linear/polar; trigonal plana/polar; angular/polar.
-
piramidal/apolar; piramidal/apolar; linear/apolar.
Alternativa “b”.
De acordo com a Teoria de Repulsão dos Pares Eletrônicos, temos:
NH3 – piramidal – polar
CHCℓ3 – tetraédrico – polar
SO3 – trigonal plana - apolar
-
-
Questão 4
(UFES) A molécula do OF2 é polar e a molécula do BeF2 é apolar. Isto se deve à (ao):
a) diferença de eletronegatividade entre os átomos nas respectivas moléculas.
b) geometria molecular.
c) tamanho dos átomos ligados ao flúor.
d) grande reatividade do oxigênio em relação ao flúor.
e) fato de o oxigênio e o flúor serem gases.
Alternativa “b”.
A molécula de OF2 é angular porque o oxigênio (átomo central) possui pares de elétrons emparelhados disponíveis. Por ser angular, os vetores momento dipolar formados não se anulam e a molécula é polar.
No caso do BeF2, que é linear (o berílio não possui pares de elétrons emparelhados disponíveis), os vetores momento dipolar formados se anulam mutuamente e a molécula é apolar.