Exercícios sobre polaridade e ebulição dos compostos orgânicos
A polaridade dos compostos orgânicos interfere na sua temperatura de ebulição, pois os compostos apolares possuem menor ponto de ebulição que os polares.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(FCM-MG)
I. CH3CH2CH2CH2CH2CH3
II. H CH3
│ │
H3C ─ C ─ C ─ CH3
│ │
CH3 HIII. CH3COCH2CH2CH2CH3
IV. CH3CH2CH2CH2CH2CH2OH
A ordem crescente das temperaturas de ebulição dos compostos acima está representada corretamente na opção:
a) I; III; II; IV.
b) II; I; III; IV.
c) II; I; IV; III.
d) II; IV; III; I.
Alternativa “b”.
Observando os compostos envolvidos, temos que o I e o II são apolares, e o III e o IV, polares. Portanto, o I e o II vêm primeiro porque os compostos apolares possuem menor ponto de ebulição que os polares. Analisando separadamente o I e o II, vemos que eles são isômeros, mas o II possui mais ramificações, por isso seu ponto de ebulição é menor.
Agora, analisando o II e o IV, vemos que o III é uma cetona, o que significa que sua força intermolecular é dipolo permanente, enquanto o IV é um álcool que realiza ligações de hidrogênio. A ligação de hidrogênio é a mais forte e, por isso, a temperatura de ebulição do IV é a maior.
-
Questão 2
(Fuvest-SP) Em um laboratório, três frascos com líquidos incolores estão sem os devidos rótulos. Ao lado deles, estão os três rótulos com as seguintes identificações: ácido etanoico, pentano e 1-butanol. Para poder rotular corretamente os frascos, determinam-se para esses líquidos o ponto de ebulição (PE) sob 1 atm e a solubilidade em água (S) a 25°C.
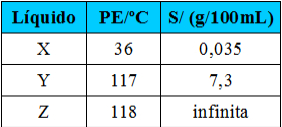
Com base nessas propriedades, conclui-se que os líquidos X, Y e Z são, respectivamente:
a) pentano, 1-butanol e ácido etanoico.
b) pentano, ácido etanoico e 1-butanol.
c) ácido etanoico, pentano e 1-butanol.
d) 1-butanol, ácido etanoico e pentano.
e) 1-butanol, pentano e ácido etanoico.Alternativa “a”.
ácido etanoico: O
║
H3C ─ C ─ OHpentano: CH3CH2CH2CH2CH3
1-butanol: CH3CH2CH2CH2OH
Visto que o pentano é o único apolar, o ponto de ebulição é o menor e ele seria o X. O 1-butanol é um álcool e o ácido etanoico é um ácido carboxílico, sendo que ambos realizam ligação de hidrogênio. Porém, o ácido, além do grupo OH, possui mais um oxigênio, por isso ele forma ligações de hidrogênio duplas entre suas moléculas, tendo uma interação intermolecular maior e, consequentemente, o seu ponto de ebulição também é maior, sendo ele o Z. Desse modo, o 1-butanol é o Y. Então, colocando na respectiva ordem X, Y, Z, temos: pentano, 1-butanol e ácido etanoico.
-
Questão 3
Dos compostos abaixo, qual apresenta maior ponto de ebulição?
a)C3H8
b)C6H14
c)C2H5OH
d)CH3Cℓ
e)C2H5OOOH
Alternativa “e”.
Esse composto é um ácido carboxílico que, além de ser uma molécula polar, também realiza ligações de hidrogênio duplas entre suas moléculas, tendo uma interação intermolecular maior e, consequentemente, o seu ponto de ebulição é o maior.
-
Questão 4
Apesar de a água e o metano apresentarem massas molares muito próximas, a temperatura de ebulição da água é bem superior à do metano. Isso se deve:
a) à maior pressão de vapor da água.
b) à maior intensidade de forças intermoleculares na água.
c) ao fato de a água ser formada por moléculas angulares e apolares.
d) à menor intensidade de forças intermoleculares na água.
e) à maior polaridade das moléculas do metano.
Alternativa “b”.
A água é polar, enquanto o metano é apolar, por isso, o metano realiza interações fracas, do tipo dipolo induzido, e a água realiza ligações de hidrogênio, que é o tipo de interação intermolecular mais intenso, sendo assim o seu ponto de ebulição é maior.
