Exercícios sobre ponte salina
Estes exercícios sobre ponte salina testarão seus conhecimentos sobre o sentido do deslocamento dos íons presentes na ponte salina em direção às semicelas.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Durante o funcionamento da pilha de Daniell, os elétrons migram do eletrodo que sofre oxidação (ânodo) em direção ao eletrodo que sofre redução (cátodo). Em contrapartida, a solução do ânodo passa a receber mais cátions por cauda da oxidação, e a solução do ânodo passa a perder cátions em virtude da redução. Sabendo que a ponte salina é o instrumento fundamental para equilibrar as soluções na pilha, assinale a alternativa correta:
a) Na ponte salina, cátions migram em direção ao ânodo.
b) Na ponte salina, ânions migram em direção ao ânodo.
c) Na ponte salina, cátions migram em direção ao cátodo.
d) Na ponte salina, os elétrons migram do ânodo em direção ao cátodo.
Letra a). Durante o funcionamento de uma pilha, a ponte salina envia para a semicela que sofre oxidação (ânodo) ânions. Já para a semicela que sofre redução (cátodo), a ponte salina envia cátions.
-
Questão 2
Durante o funcionamento de uma pilha, temos a ocorrência da transferência de elétrons de um eletrodo para outro. Isso faz com que ambas as soluções percam sua neutralidade elétrica, pois há excesso de íons, o que torna as soluções instáveis e interrompe precocemente o funcionamento da pilha. Dos instrumentos a seguir, qual é utilizado para estabilizar as soluções de uma pilha?
a) Semicela
b) Ponte salina
c) Eletrodo
d) Voltímetro
Letra b). A ponte salina é capaz de estabilizar as soluções de uma pilha porque nela existem íons (cátions e ânions), que são deslocados para o cátodo e o ânodo.
-
Questão 3
(UNIFICADO-RJ) A parte da Química que estuda o relacionamento entre a corrente elétrica e as reações químicas é a Eletroquímica. A primeira pilha foi criada em 1800 por Alessandro Volta. Essa pilha utilizava discos de cobre e zinco, separados por algodão embebido em solução salina. Em 1836, John Frederick Daniell construiu uma pilha com eletrodos de cobre e zinco, mas cada eletrodo ficava em uma cela individual, o que aumentava a eficiência da pilha, pois ela possuía um tubo que ligava as duas cubas. Essa pilha ficou conhecida como pilha de Daniell. A nomenclatura atribuída a esse tubo foi:
a) ânodo.
b) cátodo.
c) ponte salina.
d) ponte de hidrogênio.
e) circuito externo.
Letra c). Ponte salina é o nome do dispositivo que conecta as soluções presentes em cada uma das duas cubas (recipientes que contêm os eletrodos).
-
Questão 4
(PUC-ABC SP) Abaixo temos as semirreações de redução do zinco e do cobre:
Zn2+(aq) + 2e- → Zn(s) Eºredução = – 0,76V
Cu2+(aq) + 2e- → Cu(s) Eºredução = + 0,34V
Duas figuras representam aparatos eletroquímicos. A figura 1 representa uma cuba eletrolítica contendo solução aquosa de sulfato de cobre (II) e dois eletrodos de platina (I e II). Durante a aplicação de certo potencial elétrico, verifica-se a formação de gás oxigênio no eletrodo II.
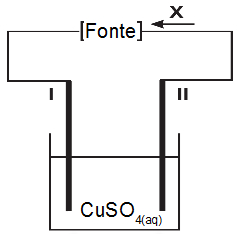
A figura 2 representa a associação de duas semicelas eletroquímicas: a primeira formada por um eletrodo de cobre (eletrodo III) imerso em uma solução aquosa de sulfato de cobre (II) e a segunda formada por um eletrodo de zinco (eletrodo IV) imerso em uma solução aquosa de sulfato de zinco. As duas semicelas são conectadas por uma ponte salina contendo solução aquosa de nitrato de potássio e por um fio metálico.
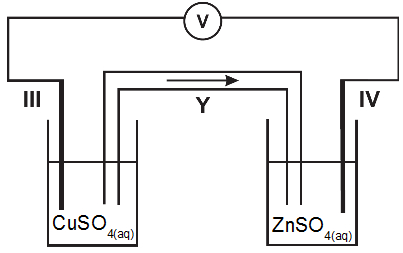
Assinale a alternativa que identifica corretamente o que as setas identificadas pelas letras X e Y representam nos dispositivos esquematizados.
a) Seta X (sentido do movimento dos elétrons) e seta Y (sentido do movimento dos cátions).
b) Seta X (sentido do movimento dos elétrons) e seta Y (sentido do movimento dos ânions).
c) Seta X (sentido da corrente elétrica) e seta Y (sentido do movimento dos cátions).
d) Seta X (sentido da corrente elétrica) e seta Y (sentido do movimento dos elétrons).
e) Seta X (sentido do movimento dos cátions) e seta Y (sentido do movimento dos ânions).
Letra b). A resposta é a letra:
-
Seta X: está no fio elétrico externo, logo, indica o sentido da corrente elétrica;
-
Seta Y: está na ponte salina e, por isso, indica trânsito de íon. Como o potencial de redução do zinco é menor que o potencial de redução do cobre, o zinco sofre oxidação, ou seja, perde elétrons e transforma-se no cátion Zn+2, o qual se direciona para a solução. Com isso, a ponte salina envia ânion para a cuba que está se enchendo de cátions.
-