Exercícios sobre Propriedades Periódicas e Aperiódicas
As propriedades periódicas assumem valores que crescem e decrescem em cada período da Tabela Periódica, já as aperiódicas variam à medida que o número atômico aumenta.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Considere as seguintes propriedades periódicas:
- Baixa energia de ionização;
- Alta eletronegatividade;
- Alta eletropositividade;
- Baixa afinidade eletrônica.
A sequência dos elementos que apresentam as propriedades relacionadas, na respectiva ordem, é:
- Li, Be, F, O
- Ne, F, O, Br
- He, K, Rb, K
- Cs, O, Rb, Li
- K, Rb, Cl, F
Alternativa “d”.
Sentidos do crescimento das propriedades periódicas em questão:
- Energia de ionização: de baixo para cima e da esquerda para a direita;
- Eletronegatividade: de baixo para cima e da esquerda para a direita;
- Eletropositividade: de cima para baixo e da direita para a esquerda;
- Afinidade eletrônica: de baixo para cima e da esquerda para a direita.
-
Questão 2
Considere as espécies abaixo e indique qual é a alternativa que apresenta corretamente a ordem crescente do raio atômico delas.
- Mg (Z = 12)
- Mg2+
- O (Z = 8)
- O2-
- Mg, Mg2+, O, O2-.
- Mg, O, Mg2+, O2-.
- O, O2-, Mg, Mg2+.
- Mg2+, Mg, O2-, O.
- Mg2+, O, O2-,Mg.
Alternativa “e”.
Distribuição eletrônica em cada caso:
- Mg (Z = 12) = 2 – 8 - 2
- Mg2+ = 2 - 8
- O (Z = 8) = 2- 6
- O2- = 2 - 8
O Mg2+ tem o raio atômico menor porque o raio atômico sempre diminui quando o átomo se transforma em um cátion, pois ele perde elétrons e sua carga nuclear efetiva (Zef) aumenta e também aumenta a atração do núcleo pelos elétrons.
O “O” é o segundo menor, pois ele possui apenas duas camadas eletrônicas como o Mg2+, porém, com menos elétrons e, por isso, tem menos atração do núcleo pelos elétrons.
O O2- é o segundo maior porque quando o elemento se transforma em um ânion, o seu núcleo acaba sendo parcialmente blindado, provocando a expansão do nível. A repulsão elétrica aumenta e os elétrons se afastam, ocupando um espaço maior e resultando em um raio atômico maior.
O Mg é o que possui maior raio atômico porque ele possui três camadas eletrônicas.
-
Questão 3
(Fesp-SP) Constituem propriedades aperiódicas dos elementos:
a) densidade, volume atômico e massa atômica.
b) ponto de fusão, eletronegatividade e calor específico.
c) volume atômico, massa atômica e ponto de fusão.
d) massa atômica, calor específico e ponto de fusão.
e) massa atômica e calor específico.
Alternativa “e”.
As propriedades aperiódicas são aquelas cujos valores só aumentam ou diminuem com o número atômico, mas não obedecem à posição na Tabela, ou seja, não se repetem em períodos regulares.
A massa atômica sempre aumenta com o número atômico, mas não diz respeito à posição deste elemento na Tabela. O calor específico (quantidade de calor necessária para elevar em 1ºC a temperatura de 1 g do elemento) do elemento sólido sempre diminui com o aumento do número atômico.
-
Questão 4
(UFMG) Com relação às propriedades periódicas, é correto afirmar que, num mesmo período, os não metais, quando comparados aos metais:
1 - São menos eletronegativos e têm menores raios atômicos;
2 - São menos eletronegativos e têm iguais raios atômicos;
4 - São mais eletronegativos e têm menores raios atômicos;
8 - Têm maiores raios atômicos e são mais eletronegativos;
16 - Têm menores raios atômicos e menores energias de ionização.
A imagem abaixo mostra a localização na Tabela Periódica dos não metais e dos metais. Mostra também o sentido do crescimento do raio atômico e da eletronegatividade:
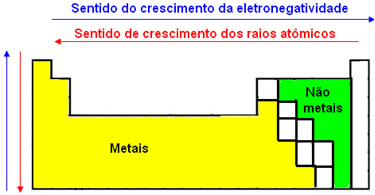
Portanto, os não metais são mais eletronegativos e têm menores raios atômicos que os metais.
