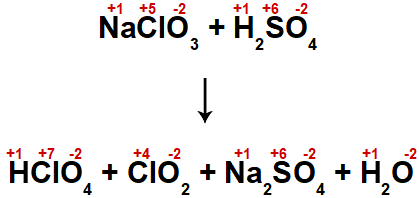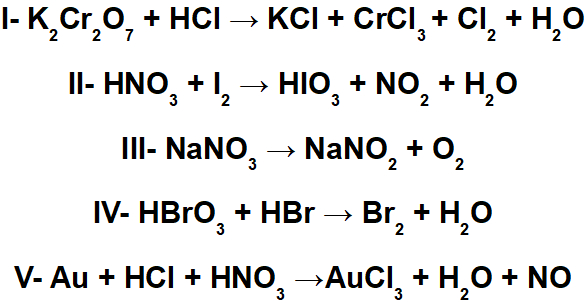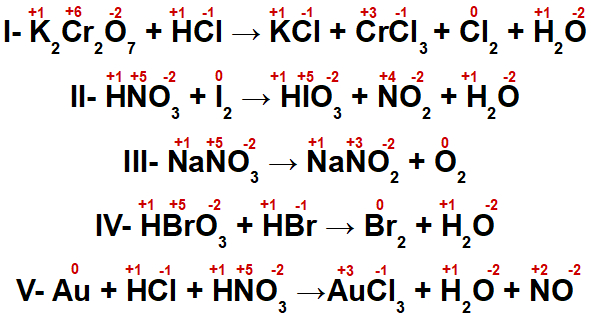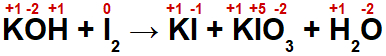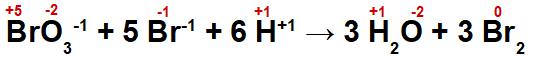Exercícios sobre reações de auto-oxirredução
Com esta lista de exercícios sobre reações de auto-oxirredução, você descobrirá se sabe identificar na equação um mesmo elemento que sofre oxidação e redução.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
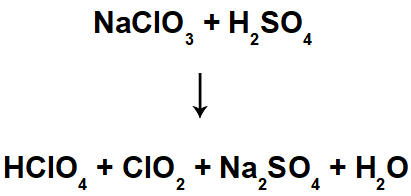
Observe a equação química abaixo:
A soma de todos os NOX do elemento químico que sofre oxidação e redução nessa reação é igual a:
a) 16
b) 22
c) 20
d) 18
e) 14
Letra a)
Para realizar a soma dos NOX do elemento que sofre oxidação e redução, devemos, inicialmente, determinar o NOX de cada um dos elementos da equação:
-
Sódio (Na): apresenta NOX +1 porque pertence à família IA da tabela periódica.
-
Hidrogênio (H): apresenta NOX +1 quando acompanhado de qualquer ametal, com exceção de quando for acompanhado por oxigênio com índice atômico 2 (O2).
-
Oxigênio (O): apresenta NOX -2 quando acompanhado por um ametal ou pelo hidrogênio (desde que a quantidade de átomos de oxigênio não seja igual a 2, por exemplo, H2O2).
-
Enxofre (S) no Na2SO4 ou no H2SO4: por estar presente em uma substância composta, seu NOX é 6:
2.(1+) + 1.x + 4.(-2) = 0
2 + x -8 = 0
x = 8 – 2
x = +6
-
Cloro (Cl) no HClO4: por estar presente em uma substância composta, seu NOX é +7:
1.(1+) + 1.x + 4.(-2) = 0
1 + x -8 = 0
x = 8 – 1
x = +7
-
Cloro (Cl) no NaClO3: por estar presente em uma substância composta, seu NOX é +5:
1.(1+) + 1.x + 3.(-2) = 0
1 + x -6 = 0
x = 6 – 1
x = +5
-
Cloro (Cl) no ClO2: por estar presente em uma substância composta, seu NOX é +4:
1.x + 2.(-2) = 0
x - 4 = 0
x = +4
Assim, analisando a equação, temos que o elemento que sofre oxidação e redução é o cloro. Somando todos os NOX dos cloros presentes na equação, temos:
Soma = + 5 +7 +4
Soma = 16
-
-
Questão 2
Qual das equações abaixo é considerada um exemplo de reação de auto-oxirredução?
a) I
b) II
c) III
d) IV
e) V
Letra d)
Para identificar qual das equações representa uma reação de auto-oxirredução, devemos, obrigatoriamente, determinar o NOX de cada um dos elementos:
-
Potássio (K) no K2Cr2O7 e no KCl: apresenta NOX +1 porque pertence à família IA da tabela periódica.
-
Sódio (Na) no NaNO3 e no NaNO2: apresenta NOX +1 porque pertence à família IA da tabela periódica.
-
Hidrogênio (H) no HCl, HBr, H2O, HNO3,HBrO3 e no HIO3: apresenta NOX +1 quando acompanhado de qualquer ametal, com exceção de quando for acompanhado por oxigênio com índice atômico 2 (O2).
-
Oxigênio (O): apresenta NOX -2 quando acompanhado por um ametal ou pelo hidrogênio (desde que a quantidade de átomos de oxigênio não seja igual a 2, por exemplo, H2O2).
-
Cromo (Cr) no K2Cr2O7 : por estar presente em uma substância composta, seu NOX é +6:
2.(1+) + 2.x + 7.(-2) = 0
2 + 2x -14 = 0
2x = 14 – 2
2x = +12
x = +12
2x = +6
-
Bromo (Br), cloro (Cl), oxigênio (O) e ouro (Au) no Cl2, Br2 e O2, respectivamente: por serem substâncias simples, o NOX é 0.
-
Nitrogênio NaNO3 ou no HNO3, Iodo no HIO3 e bromo no HBrO3: por estarem presentes em substâncias compostas, o NOX é +5:
1.(1+) + x + 3.(-2) = 0
1 + x -6 = 0
x = 6 – 1
x = +5
-
Nitrogênio no NO: por estar presente em uma substância composta, seu NOX é +2:
1.(x) + 1.(-2) = 0
x - 2 = 0
x = +2
-
Ouro (Au) no AuCl3 e cromo (Cr) no CrCl3: por estarem presentes em substâncias compostas, o NOX é +3:
1.(x) + 3.(-1) = 0
x - 3 = 0
x = +3
-
Cloro (Cl) no KCl e bromo (Br) no KBr: por estarem presentes em substâncias compostas, o NOX é -1:
1.(1+) + 1.x = 0
1 + x = 0
x = – 1
Assim, analisando as equações acima, os átomos de bromo (equação IV) nos reagentes apresentam NOX diferentes do átomo de bromo no produto.
-
-
Questão 3
(IFPE) Para prevenir doenças como o bócio, que é uma doença causada pela falta de iodo no organismo, o Ministério da Saúde recomenda adicionar ao sal de cozinha 0,25mg de iodo para cada quilograma de sal. O iodo é adicionado ao sal na forma de iodato de potássio (KIO3), que pode ser obtido por meio da reação (não balanceada) entre o hidróxido de potássio (KOH) e o iodo molecular (I2). Na reação, além do iodato de potássio (KIO3), também se obtém iodeto de potássio (KI) e água, como mostra a reação abaixo:
Tomando por base as informações apresentadas, assinale a alternativa verdadeira:
a) O potássio no KOH sofre redução, enquanto o iodo sofre oxidação.
b) O KOH é o agente oxidante, enquanto o KI é o agente redutor.
c) A soma dos coeficientes dos menores números inteiros nas substâncias dos produtos é 12.
d) O hidrogênio oxida-se, variando seu NOX de 1– para 1+.
e) É uma reação de auto-oxirredução ou de desproporcionamento.
Letra e)
Determinando o NOX, inicialmente, de cada elemento da reação, temos:
-
Iodo (I) no l2: por ser uma substância simples, seu NOX é 0.
-
Potássio (K): apresenta NOX +1 porque pertence à família IA da tabela periódica.
-
Oxigênio (O): apresenta NOX -2 quando acompanhado por um ametal ou pelo hidrogênio (desde que a quantidade de átomos de oxigênio não seja igual a 2, por exemplo, H2O2).
-
Hidrogênio (H): apresenta NOX +1 quando acompanhado de qualquer ametal, com exceção de quando for acompanhado por oxigênio com índice atômico 2 (O2).
-
Iodo (l) no KI ou bromo (Br) no KBr: por estarem presentes em substâncias compostas, o NOX é -1:
1.(1+) + 1.x = 0
1 + x = 0
x = – 1
-
Iodo no KIO3: por estar presente em uma substância composta, seu NOX é +5:
1.(1+) + x + 3.(-2) = 0
1 + x -6 = 0
x = 6 – 1
x = +5
Analisando a equação, percebemos que o elemento iodo (I) apresenta um NOX no reagente e outros dois NOX diferentes no produto. Por isso, podemos afirmar que é uma reação de auto-oxirredução ou de desproporcionamento.
-
-
Questão 4
(Uel) Em relação à reação representada na equação abaixo, marque a alternativa correta:
a) BrO3-1 sofre auto-oxirredução.
b) Br-1 reduz H+1 a H2O.
c) H+1 oxida Br-1 a Br2.
d) BrO3-1 reduz H+1 a H2O.
e) BrO3-1 oxida Br-1 a Br2.
Letra e)
Ao determinar o NOX de cada elemento na equação, temos:
-
Br-1: é um íon simples, logo seu NOX é igual à sua carga, ou seja, -1.
-
H+1: é um íon simples, logo seu NOX é igual à sua carga, ou seja, +1.
-
Oxigênio (O): apresenta NOX -2 quando acompanhado por um ametal ou pelo hidrogênio (desde que a quantidade de átomos de oxigênio não seja igual a 2, por exemplo, H2O2).
-
Hidrogênio (H): apresenta NOX +1 quando acompanhado de qualquer ametal, com exceção de quando for acompanhado por oxigênio com índice atômico 2 (O2).
-
Bromo (Br) no Br2: por ser uma substância simples, seu NOX é 0.
-
Bromo (Br) no BrO3-1: por ser um íon composto, a somatória dos NOX é sempre igual à carga:
1.x + 3.(-2) = -1
x -6 = -1
x = -1 + 6
x = +5
Observando a equação acima, concluímos que:
-
Br2: sofre auto-oxirredução;
-
H não sofre variação de NOX;
-
Br-1 é oxidado a Br2 pela ação de BrO3-1.
-