Exercícios sobre Reações da Eletrólise
Para resolver estes exercícios sobre reações da eletrólise, você precisa saber identificar o ânodo e o cátodo, bem como as respectivas semirreações que ocorrem nesses eletrodos.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(UFMG) O diagrama a seguir mostra um esquema utilizado para recuperar moedas de cobre antigas, parcialmente oxidadas.
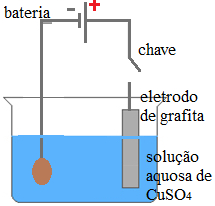
Esquema de eletrólise em meio aquosoO processo que ocorre na superfície da moeda é:
a) Cu2+(aq)+ 2 e- → Cu(s)
b) Cu(s) → Cu²⁺ + 2 e-
c) 2 H2O(l)→ 1 O2(g) + 4 H1+(aq) + 4 e-
d) 4 OH1-(aq) →1 O2(g) + 2 H2O(l) + 4 e-
e) 1 O2(g) + 4 H1+(aq) +4 e- → 2 H2O(l)
Alternativa “a”.
Esse é um processo de galvanoplastia ou eletrodeposição metálica em que o cátion cobre II da solução recebe elétrons e deposita-se sobre a moeda que constitui o cátodo.
-
Questão 2
(UFPR) O elemento químico alumínio é o terceiro mais abundante na Terra, depois do oxigênio e do silício. A fonte comercial do alumínio é a bauxita, um minério que, por desidratação, produz a alumina, Al2O3. O alumínio metálico pode então ser obtido pela passagem de corrente elétrica através da alumina fundida, processo que, devido ao seu elevado ponto de fusão (2050 °C), requer um considerável consumo de energia. Acrescente-se ainda o alto custo envolvido na extração do alumínio de seu óxido e tem-se um processo energeticamente muito dispendioso. Somente a partir de 1886, quando Charles Hall descobriu que a mistura de alumina com criolita (NA3AlF6) fundia a 950 °C, o que tornava o processo de obtenção de alumínio menos dispendioso, foi possível a utilização desse elemento em maior escala. A figura abaixo representa o dispositivo empregado para a extração do alumínio pela passagem de corrente elétrica.
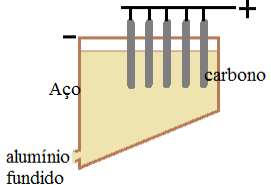
Ilustração em exercício sobre reações da eletróliseAs semirreações que ocorrem são:
I. Al3+(fund.) + 3e- → Al(l)
II. 2 O2-(fund.) + C(s) → CO2(g) + 4e-
Massa molar: Al = 27,0 g/mol
Com base nas informações acima, é correto afirmar:
01. A fusão dos minérios é necessária para permitir o deslocamento dos íons para os respectivos eletrodos;
02. A reação II indica que o cátodo é consumido durante o processo.
04. A redução do alumínio ocorre no eletrodo de aço.
08. O processo de obtenção do alumínio metálico é uma eletrólise.
16. A soma dos menores coeficientes estequiométricos inteiros na reação total de obtenção do alumínio é 20.
32. A produção de uma lata de refrigerante (13,5 g de alumínio) absorve 0,500 mol de elétrons.29: Estão corretos os itens 01,04, 08 e 16.
02. Falsa. A reação II ocorre no ânodo, e não no cátodo.
16. Verdadeira. A soma dos menores coeficientes estequiométricos inteiros na reação total de obtenção do alumínio é 20, pois, com base nas informações do texto, temos:
4 Al3+(fund.) +12 e- → 4 Al(l)
6 O2-(fund.) + 3 C(s) → 3 CO2(g) + 12 e-
4 Al3+(fund.) + 6 O2-(fund.) + 3 C(s) → 4 Al(l) + 3 CO2(g)Soma dos coeficientes: 4 + 6 + 3 + 4 + 3 = 20.
32. Falsa. A produção de uma lata de refrigerante (13,5 g de alumínio) absorve1,5 mol de elétrons, e não 0,500 mol:
27 g de Al ------- 3 mol de e-
13,5 g de Al ----- x
x = 13,5 . 3/27
x = 1,5 mol de elétrons
-
Questão 3
Em uma cuba eletrolítica, foi realizada a eletrólise ígnea do CaF2. Quais são as reações dessa eletrólise?
a) Ânodo:Ca2+ + 2 e- → Ca
Cátodo: 2 F-→ F2 + 2 e-
Reação Global: 2 F- + Ca2+ → F2 + Ca
b) Ânodo: 2 F-→ F2 + 2 e-
Cátodo: Ca2+ + 2 e- → Ca
Reação Global: 2 F- + Ca2+ → F2 + Ca
c) Ânodo: 2 F-→ F2 + 1 e-
Cátodo: Ca2+ + 2 e- → Ca
Reação Global: 2 F- + Ca2+ + 1 e- → F2 + Ca
d) Ânodo: Ca+ + 1 e- → Ca
Cátodo: F-→ F + 1 e-
Reação Global: F- + Ca+ → F + Ca
e) Ânodo: 2 F-→ F2 + 2 e-
Cátodo: Ca2+ + 2 e- → Ca
Reação Global: 2 F- + Ca2+ → CaF2
Alternativa “b”.
-
Questão 4
Considere a eletrólise de solução aquosa de sulfato de cobre II. São dadas a seguir as semirreações e seus respectivos potenciais-padrão de redução:
1- Cu2+(aq)+ 2 e- → Cu(s) E0 = +0,34 V
2- 2 H+(aq)+ 2 e- → H2(s) E0 = +0,00 V
3- 2 H2O(l)+ 2 e- → H2(s) + OH-(aq) E0 = -0,83 V
4-1 O2(g) + 4 H1+(aq) + 4 e- → 2 H2O(l) E0 = +1,23 V
5- 1 O2(g) +2 H2O(l) + 4 e- → 4 OH-(aq) E0 = +0,40 V
Indique as reações que podem ocorrer no cátodo e qual efetivamente se processa nesse eletrodo:
a) Todas podem ocorrer no cátodo, mas a que efetivamente se processa é a reação 2.
b) Apenas as reações 1, 2 e 4 podem ocorrer no cátodo, mas a que efetivamente se processa é a reação 2.
c) Apenas as reações 2 e 5 podem ocorrer no cátodo, mas a que efetivamente se processa é a reação 2.
d) Apenas as reações 1, 2 e 3 podem ocorrer no cátodo, mas a que efetivamente se processa é a reação 2.
e) Apenas a reação 3 pode ocorrer no cátodo.
Alternativa “d”.
As espécies que podem sofrer redução no cátodo são Cu2+, H+ e H2O. Mas como o potencial de redução do Cu2+ é o mais alto, essa semirreação processa-se no eletrodo negativo da célula.