Exercícios sobre superfície de contato e velocidade das reações
Estes exercícios abordam situações do dia a dia em que a superfície de contato afeta a velocidade das reações químicas.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(Puccamp-SP) Considere as duas fogueiras representadas a seguir, feitas, lado a lado, com o mesmo tipo e quantidade de lenha.
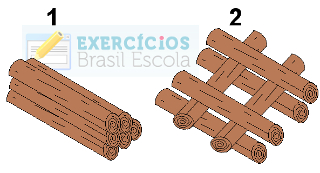
Toras de madeira em exercício sobre superfície de contato e velocidade das reaçõesA rapidez da combustão da lenha será:
a) maior na fogueira 1, pois a superfície de contato com o ar é maior.
b) maior na fogueira 1, pois a lenha está mais compactada, o que evita a vaporização de componentes voláteis.
c) igual nas duas fogueiras, uma vez que a quantidade de lenha é a mesma e estão no mesmo ambiente.
d) maior na fogueira 2, pois a lenha está menos compactada, o que permite maior retenção de calor pela madeira.
e) maior na fogueira 2, pois a superfície de contato com o ar é maior.Alternativa “e”.
-
Questão 2
(UFRGS-RS) Indique, entre as alternativas abaixo, a forma mais rapidamente oxidável para um material de ferro, supondo-as todas submetidas às mesmas condições de severidade.
a) Limalha. b) Chapa plana. c) Esferas. d) Bastão. e) Lingote.
Alternativa “a”.
-
Questão 3
Em dois béqueres foram dissolvidos comprimidos efervescentes em uma mesma quantidade de água. No primeiro béquer, colocou-se o comprimido inteiro. No segundo béquer, colocou-se o comprimido em pó. O comprimido do segundo béquer dissolveu-se mais rapidamente. Isso ocorreu porque:
a) A concentração dos reagentes no segundo béquer era maior.
b) Houve a atuação de um catalisador no segundo béquer.
c) A superfície de contato entre os reagentes era maior no segundo béquer.
d) A temperatura era maior no segundo béquer.
e) Não precisou passar pela formação do complexo ativado na reação do segundo béquer.
Alternativa “c”.
No comprimido em pó, os grãos oferecem maior superfície de contato com a água, o que aumenta a probabilidade de colisões favoráveis. Logo, a reação fica mais rápida.
-
Questão 4
O metal ferro reage com uma solução aquosa de HCl, originando gás hidrogênio e cloreto de ferro II. Assinale a alternativa que indica a reação mais rápida entre o ferro e uma solução de 1 mol/L de HCl:
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
a) Um prego de ferro a 25ºC.
b) Um prego de ferro a 40ºC.
c) Ferro em pó a 40ºC.
d) Ferro a 25ºC.
e) Essa reação não depende da superfície de contato ou da temperatura.
Alternativa “c”.
O ferro em pó aumenta a superfície de contato dos átomos de ferro e as moléculas de HCl, aumentando a probabilidade de colisões favoráveis e a ocorrência da reação. Além disso, quanto maior a temperatura, maior a velocidade das reações.