Exercícios sobre Transformação Isobárica
A transformação isobárica ocorre em um sistema com pressão constante, em que o volume de determinada massa fixa de um gás é diretamente proporcional à temperatura.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Um gás no estado 1 apresenta volume de 14 L, pressão de 5 atm e temperatura de 300 K. Qual será o volume do gás em um estado 2 se a temperatura for dobrada à pressão constante?
-
0,14 L.
-
7 L.
-
28 L.
-
32 L.
-
2520000 L.
Alternativa “c”.
V1= V2
T1 T2
14 L_= __V2__
300 K 600K
300 . V2 = 14 . 600
V2 = 8400/300
V2 = 28 L -
-
Questão 2
Em uma pressão constante, um gás é aquecido até que seu volume inicial de 150 L dobre. Se a temperatura inicial do gás era de 20ºC, qual deve ser a temperatura final na escala kelvin?
-
40.
-
586.
-
233.
-
313.
-
273,025.
Alternativa “b”.
OBS.: como a temperatura inicial é de 20OC deevemos somá-la com 273 para converte-la em Kelvim, o que irá resultar em 293
Vinicial = Vfinal
Tinicial Tfinal
150_ = 300
293 Tfinal
150 . Tfinal = 293 . 300
Tfinal = 87900
150
Tfinal = 586 K -
-
Questão 3
(UFRGS-RS) Considere a seguinte transformação que ocorre com uma amostra gasosa de massa “m” apresentando comportamento de gás ideal.
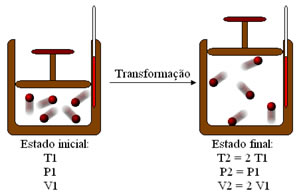
O gráfico que melhor representa essa transformação é:
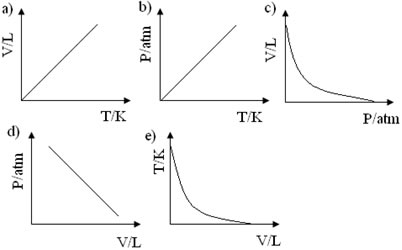
Alternativa “a”.
Observe que P1 é igual a P2, o que significa que a pressão é constante. Assim, é uma transformação isobárica representada graficamente por retas inclinadas. Dobrando-se a temperatura termodinâmica, o volume ocupado pelo gás dobra. Assim, no gráfico, é relacionado o volume com a temperatura, que são diretamente proporcionais.
-
Questão 4
(UnB-DF) Um balão que contém gás oxigênio (O2), mantido sob pressão constante, tem volume igual a 10 L, a 27°C. Se o volume for dobrado, podemos afirmar que:
a)A temperatura em C° dobra.
b)A temperatura em K dobra.
c)A temperatura em K diminui à metade.
d)A temperatura em °C diminui à metade.
e)A temperatura em K aumenta de 273 K.
Alternativa “b”.
Visto que a pressão permanece constante, trata-se de uma transformação isobárica, em que o volume e a temperatura na escala Kelvin são diretamente proporcionais. Mas o volume e a temperatura em graus Celsius não são grandezas diretamente proporcionais. Assim, se o volume dobra, a temperatura em K dobra.