Exercícios sobre Transformação Isocórica ou Isovolumétrica
Relacione a pressão e a temperatura dos gases que sofrem variações sob volume constante ao resolver estes exercícios sobre transformação isocórica ou isovolumétrica.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(UEPG-PR) Um recipiente fechado de volume “V” contém certa massa gasosa à temperatura de 27°C, exercendo uma pressão de 760 mmHg. Após aquecimento, verificou-se que o novo valor da pressão era de 2 atm. Supondo desprezível a variação de volume, a nova temperatura, em °C, do sistema será:

Gráfico de transformação isocórica ou isovolumétricaa) 600°C.
b) 540°C.
c) 327°C.
d) 273°C.
e) 160°C.
Alternativa “c”.
Dados:
V = constante (transformação isocórica);
Tinicial = 27ºC = 300 K (A Lei de Charles e Gay-Lussac é verdadeira apenas na temperatura absoluta, isto é, na escala kelvin. Por isso, precisamos usar essa unidade primeiro e somente no final do exercício transformar para graus Celsius).
Pinicial = 760 mmHg = 1 atm;
Pfinal = 2 atm;
Tfinal = ?
* Usando a relação estabelecida por Charles e Gay-Lussac para as transformações isocóricas ou isovolumétricas, temos:
Pinicial = Pfinal
Tinicial TfinalTfinal = Tinicial . Pfinal
PinicialTfinal = 300 K . 2 atm
1 atmTfinal = 600 K = 600 – 273 = 327 ºC.
-
Questão 2
(Mack-SP) Uma determinada massa fixa de gás contido em um balão encontra-se inicialmente em CNTP.
Em uma transformação isovolumétrica, sabendo-se que a pressão máxima interna permitida pelo balão é de 3,0 atm, se dobrarmos a temperatura absoluta inicial, a pressão final do gás e o efeito sobre o balão serão:
a) 2,0 atm e o balão não estoura
b) 2,0 atm e o balão estoura
c) 3,0 atm e o balão estoura
d) 1,5 atm e o balão não estoura
e) 1,0 atm e o balão não estouraAlternativa “a”.
Dados:
Nas CNTP (Condições Normais de Temperatura e Pressão, a temperatura é de 273 K e a pressão é de 1 atm):
Tinicial = 273 K
Pinicial = 1 atm;
Tfinal = 546 K (dobrou a temperatura = 273 . 2)
Pfinal = ?
* Calculando a pressão exercida pelo gás nas condições finais:
Pinicial = Pfinal
Tinicial TfinalPfinal = Pinicial . Tfinal
TinicialPfinal = 1 atm . 546 K
273 KPfinal = 2 atm
Visto que essa pressão exercida pelo gás é menor que a pressão máxima interna permitida pelo balão (3 atm), o balão não estoura.
-
Questão 3
Um gás no estado 1 apresenta volume de 14 L, pressão de 5 atm e temperatura de 300 K. Qual será a pressão do gás em um estado II se o volume permanecer igual a 14 L, mas a temperatura passar para 273 K?
a) 4,55 atm
b) 5,49 atm
c) 0,25 atm
d) 6,75 atm
e) 9,23 atm
Alternativa “a”.
Pinicial = Pfinal
Tinicial TfinalPfinal = Pinicial . Tfinal
TinicialPfinal = 5 atm . 273 K
300 KPfinal = 4,55 atm
-
Questão 4
Considere a seguinte transformação que ocorreu com uma amostra de gás ideal de massa “m”:
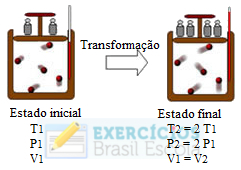
Exercícios sobre transformação isocórica ou isovolumétricaQual dos gráficos abaixo melhor representa essa transformação?
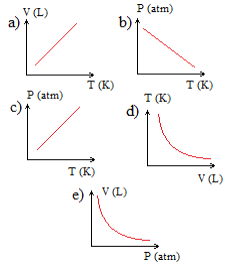
Gráficos em exercício sobre transformação gasosaAlternativa “c”.
Essa é uma transformação isovolumétrica ou isocórica, porque o volume permaneceu constante, sendo que o gráfico dessa transformação sempre origina uma reta crescente, pois, com o aumento da temperatura, a pressão aumenta proporcionalmente.