Exercícios sobre Transformação Isotérmica
Na transformação isotérmica, a temperatura dos gases permanece constante e, segundo a Lei de Boyle, o volume e a temperatura são inversamente proporcionais.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Certa massa de gás hidrogênio (H2) ocupa um volume de 0,760 L, sob pressão de 125 mm Hg, em uma dada temperatura. Qual o volume ocupado pela mesma massa de H2, na mesma temperatura, sob pressão de 0,100 atm?
-
1,25 L.
-
0,125 L.
-
125 L.
-
950 L.
-
95 L.
Alternativa “a”.
* Primeiro precisamos passar todas as unidades de pressão para atm:
1 atm ---- 760 mm Hg
x---------- 125 mm Hg
x = 0,164 atmP1 . V1 = P2 . V2
0,164 . 0,760 = 0,100 . V2
0,100 . V2 = 0,125
V2 = 0,125/0,100
V2 = 1,25 L -
-
Questão 2
Certa quantidade de um gás ocupa um volume de 120 L em pressão de 700 mmHg e temperatura de 20 ºC. Qual será a pressão quando o volume for apenas de 30 L, mantendo-se a temperatura constante?
-
2800 mmHg.
-
3200 mmHg.
-
1400 mmHg.
-
1800 mmHg.
-
2000 mmHg.
Alternativa “a”.
P1 . V1 = P2 . V2
P2 = P1 . V1
V2
P2 = 700 . 120
30
P2 = 2800 mmHg -
-
Questão 3
(PUC-RJ) A cada 10 m de profundidade a pressão sobre um mergulhador aumenta 1 atm com relação à pressão atmosférica. Sabendo-se disso, qual seria o volume de 1 L de ar (comportando-se como um gás ideal) inspirado pelo mergulhador ao nível do mar, quando ele estivesse a 30 m de profundidade?
-
3 L.
-
4 L.
-
25 mL.
-
250 mL.
-
333 mL.
Alternativa “d”.
P1 . V1 = P2 . V2
1 atm . 1 L = 4 atm . V2
4V2 = 1
V2 = 1/4
V2 = 0,25 L = 250 mL -
-
Questão 4
(PUC-PR) Qual o volume ocupado, a 2 atm de pressão, por certa massa de gás ideal que sofre transformações isotérmicas conforme o gráfico?
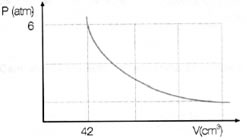
a) 42 cm3
b) 14 cm3
c) 21 cm3
d) 126 cm3
e) impossível calcular, pois faltam dados.
Alternativa “d”.
P1 . V1 = P2 . V2
V1 = P2 . V2
P1
V1 = 6 . 42
2
V1 = 126 cm3.