Exercícios sobre variação da concentração em equilíbrio químico
Quando ocorre uma variação na concentração dos reagentes ou dos produtos de uma reação em equilíbrio químico, a reação se desloca no sentido de minimizar esse efeito.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Considere o equilíbrio:
2H2(g) + O2(g) ↔ 2H2O(g) + calor
Marque a(s) alternativa(s) que causaria(m) o deslocamento do equilíbrio para a esquerda (sentido de formação dos reagentes):
-
Aumento da concentração de água.
-
Aumento da concentração de gás hidrogênio.
-
Aumento da concentração de gás oxigênio.
-
Diminuição da concentração de água.
-
Diminuição da concentração de gás hidrogênio.
Alternativas “a” e “e”.
-
-
Questão 2
O gráfico a seguir mostra o comportamento do equilíbrio entre reagentes e produtos, em temperatura constante, para a formação do trióxido de enxofre:
2SO2(g) + O2(g) ↔ 2SO3(g)

Qual dos gráficos abaixo descreve corretamente o que ocorre caso houvesse um aumento da concentração de SO2?
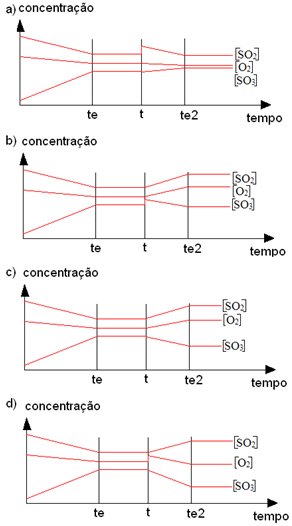
Alternativa “a”.
Quando houve um aumento na concentração do SO2, o equilíbrio foi deslocado no sentido de formação do produto (SO3) com gradativo aumento da sua concentração e diminuição da concentração dos reagentes. Com o tempo, atingiu-se novamente o equilíbrio químico.
-
Questão 3
(Ufes) Considere a reação hipotética:
A + B ↔ C + D
Com relação ao equilíbrio químico do sistema, em temperatura constante, pode-se afirmar que:
a) a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.
b) a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.c) a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio.
d) a adição de reagentes ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio.
e) a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio.Alternativa “c”.
Com a adição de reagentes ao sistema, a reação se deslocará no sentido da formação dos produtos. Já no caso de se adicionar mais produto, o deslocamento será no sentido da formação dos reagentes. Mas em ambos os casos irá ocorrer que, com o tempo, o equilíbrio será atingido novamente. Com isso, a razão entre as concentrações dos produtos e reagentes se manterá constante, ou seja, o valor da constante de equilíbrio Kc permanecerá o mesmo. Apenas se houvesse alguma variação na temperatura é que a constante de equilíbrio mudaria de valor.
-
Questão 4
(UFC-CE) No estudo da ação do gás venenosos COCl2(g), usado como arma química, observa-se o processo de decomposição do mesmo de acordo com a reação:
COCl2(g) ↔ CO(g) + Cl2(g)
Partindo de uma situação de equilíbrio, adicionou-se 0,10 mol de CO(g) e o sistema, após algum tempo, chegou a uma nova situação de equilíbrio. Marque a opção que indica como as novas concentrações do equilíbrio estão relacionadas com as antigas.
[COCl2] [CO] [Cl2]
a) nova > antiga nova > antiga nova < antiga
b) nova > antiga nova > antiga nova > antiga
c) nova < antiga nova > antiga nova < antiga
d) nova > antiga nova < antiga nova < antiga
e) mesma mesma mesma
Alternativa “a”.
A adição de CO(g) desloca o equilíbrio no sentido da formação de COCl2(g).