Exercícios sobre variação da entalpia em reações exotérmicas
Estes exercícios sobre variação da entalpia em reações exotérmicas apresentam gráficos que reforçam o cálculo e a identificação desses processos químicos.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
(UFRRJ) Desde a pré-história, quando aprendeu a manipular o fogo para cozinhar seus alimentos e se aquecer, o homem vem percebendo sua dependência cada vez maior das várias formas de energia. A energia é importante para uso industrial e doméstico, nos transportes, etc.
Existem reações químicas que ocorrem com liberação ou absorção de energia, sob a forma de calor, denominadas, respectivamente, como exotérmicas e endotérmicas. Observe o gráfico a seguir e assinale a alternativa correta:
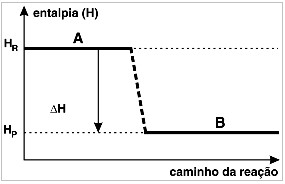
Gráfico de uma reação exotérmicaa) O gráfico representa uma reação endotérmica.
b) O gráfico representa uma reação exotérmica.
c) A entalpia dos reagentes é igual à dos produtos.
d) A entalpia dos produtos é maior que a dos reagentes.
e) A variação de entalpia é maior que zero.
Letra b). O gráfico é de uma reação exotérmica porque a entalpia dos reagentes (Hr) apresenta maior valor que a entalpia dos produtos (Hp).
-
Questão 2
(UEPG PR) Durante a Guerra do Golfo, os soldados aqueciam seus alimentos utilizando-se de recipientes de plástico que continham magnésio metálico. Para que houvesse o aquecimento, pequenas quantidades de água eram adicionadas ao magnésio, produzindo hidróxido de magnésio e hidrogênio. O diagrama de entalpia dessa reação é mostrado na figura abaixo. Com relação a esse diagrama, assinale o que for correto.
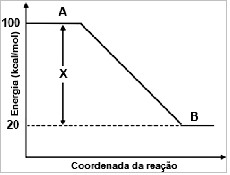
Gráfico da entalpia do hidróxido de magnésio01. A reação do magnésio com a água é exotérmica.
02. A entalpia da reação é de H = 80 kcal/mol.
04. O valor de X representa a variação de entalpia da reação.
08. A representa os reagentes da reação, Mg(s) e H2O(l), e B, os produtos Mg(OH)2(s) e H2(g).
16. A diminuição da entalpia de A para B indica que houve liberação de calor.
Todos os itens são verdadeiros.
01- Reagente (A) com maior valor de energia (entalpia) que o produto (B);
02- ΔH = Hp – Hr
ΔH = 20 – 100
ΔH = - 80 Kcal;04 – Verdadeiro porque a variação da entalpia vai dos reagentes até os produtos.
08 – Verdadeiro porque o enunciado diz que o magnésio entra em contato com a água, logo eles são os reagentes.
16 – Verdadeiro porque a entalpia dos reagentes (Hr) é maior que a entalpia dos produtos (Hp), o que caracteriza uma reação exotérmica.
-
Questão 3
Dado o gráfico:
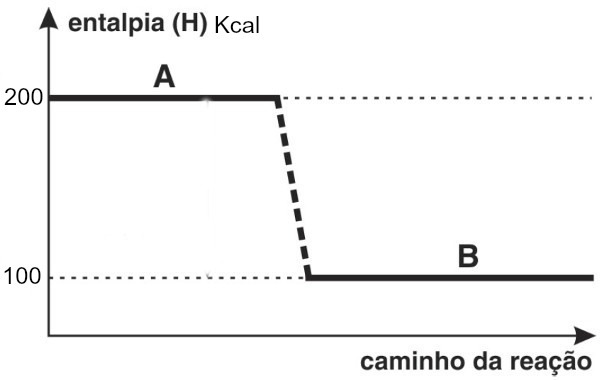
Gráfico de entalpia de uma reação genéricaPara um reação genérica representada pela equação:
A → B
Qual será o valor da variação de entalpia do processo?
a) - 50 Kcal
b) - 150 Kcal
c) - 100 Kcal
d) - 250 Kcal
e) - 300 Kcal
Letra c).
Analisando o gráfico, retiramos os seguintes dados:
Hr = 200 Kcal
Hp = 100 KcalBasta aplicar a fórmula do ΔH para calculá-lo:
ΔH = Hp – Hr
ΔH = 100 – 200
ΔH = -100 Kcal -
Questão 4
Muitos são os exemplos de processos exotérmicos que ocorrem em nosso dia a dia, como o cozimento de um alimento ou a combustão dos combustíveis de um veículo automotor. O gráfico a seguir representa de uma forma geral qualquer fenômeno exotérmico, pois:
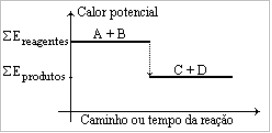
Gráfico da entalpia de um fenômeno exotérmicoa) sua energia de ativação é baixa.
b) sua energia de ativação é alta.
c) não apresenta dados sobre a pressão do sistema.
d) a entalpia dos reagentes é menor que a dos produtos.
e) a entalpia dos produtos é menor que a dos reagentes.
Letra e).
Hp < Hr
ΔH = Hp – Hr
ΔH é negativo (exotérmico)
