Exercícios sobre variação de entalpia de solução
Com estes exercícios, você pode avaliar seus conhecimentos sobre variação de entalpia de solução, que está relacionada com a dissolução de um soluto em um solvente.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Calor de dissolução ou entalpia-padrão de dissolução é o calor envolvido no processo de dissolução de 1 mol de substância em quantidade de água suficiente para formar uma solução diluída. Experimentalmente, sabe-se que a dissolução de certas substâncias, como NaOH, libera calor para o meio, já outras substâncias têm sua dissolução aumentada pela absorção de calor do meio.
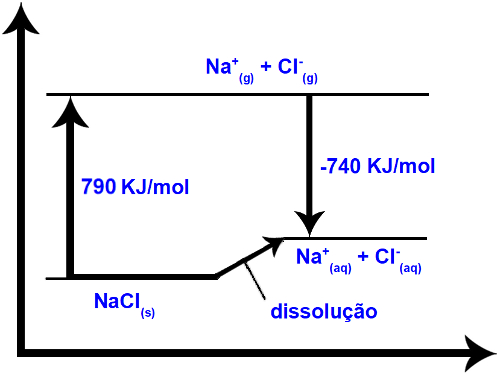
Diagrama de dissolução do NaClSobre o diagrama acima, podemos afirmar que:
a) É um processo endotérmico e envolve 50 KJ de energia.
b) É um processo exotérmico e envolve 50 KJ de energia.
c) É um processo isotérmico.
d) É um processo endotérmico e envolve 20 KJ de energia.
e) É um processo exotérmico e envolve 50 KJ de energia.
Letra e)
Analisando o gráfico, temos que a quebra das ligações do cristal de NaCl(s) absorve uma energia de 790 KJ, enquanto que, durante a hidratação, temos a liberação de 740 KJ de energia. Logo, podemos afirmar que o processo de dissolução é endotérmico e envolve 50 KJ de energia.
-
Questão 2
Quando um soluto é dissolvido em água, a primeira etapa é a separação de seus íons que estão num retículo cristalino. Para romper as ligações entre os íons, é necessário fornecer energia ao sistema. Depois da separação, os íons são envolvidos pelas moléculas do solvente. Os dipolos da água são atraídos, respectivamente, pelos íons de carga oposta. Assim, para que haja essa interação, é necessária a liberação de energia. Essa energia liberada é chamada de:
a) Entalpia de formação
b) Entalpia de hidratação
c) Entalpia de cristalização
d) Entalpia reticular
e) Entalpia da solução
Letra b)
A etapa da dissolução que envolve a energia relacionada ao envolvimento dos íons pela molécula do solvente é denominada entalpia de hidratação.
a- Energia envolvida quando uma substância composta está sendo formada a partir de substâncias simples.
c- Energia envolvida quando uma substância que estava dissolvida volta à sua forma de cristal.
d- Energia necessária para o rompimento das ligações dos átomos do soluto.
e- Somatória da entalpia reticular com a entalpia de hidratação.
-
Questão 3
(UFMG) O cloreto de sódio (NaCl) é um composto iônico solúvel em água. Sua dissolução pode ser assim representada:
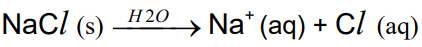
Equação da dissolução do cristal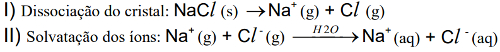
Etapas do processo de dissolução do salConsiderando essas etapas da dissolução do cristal, é CORRETO afirmar que:
a) Na etapa da solvatação dos íons do cloreto de sódio, ocorre liberação de energia.
b) Na água pura, as interações entre as moléculas são mais fortes que as interações entre os íons no cristal.
c) Na solução de cloreto de sódio, as moléculas de água estabelecem ligações de hidrogênio com os íons sódio.
d) Na etapa da dissociação do cloreto de sódio, a energia do retículo cristalino é liberada.
Letra a)
Durante a dissolução de um composto iônico em água, a etapa de solvatação é sempre exotérmica.
-
Questão 4
(Mack-SP)
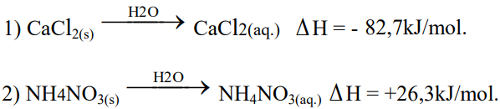
Equações das compressasUma aplicação interessante do calor de dissolução são as compressas de emergência (saco plástico com cloreto de cálcio ou nitrato de amônio e ampola de água), usadas em atletas com contusões. A partir da equação acima, são feitas as seguintes afirmações:
I. O cloreto de cálcio é usado em compressas quentes.
II. O nitrato de amônio é usado em compressas frias.
III. A equação 1 representa uma reação exotérmica.
Dessas afirmações,
a) somente I está correta.
b) somente II está correta.
c) somente I e III estão corretas.
d) somente I e II estão corretas.
e) I, II e III estão corretas.
Letra e)
I- Quando dissolvido em água, o ΔH do cloreto de cálcio é negativo, o que indica liberação de calor. Logo, quando aproximamos nossa pele dessa compressa, sentimos calor.
II- Quando dissolvido em água, o ΔH do nitrato de amônio é positivo, o que indica absorção de calor. Logo, quando aproximamos nossa pele dessa compressa, sentimos frio.
III- A equação 1 é exotérmica, porque o ΔH é negativo.