Exercícios sobre variação da temperatura em equilíbrio químico
A variação da temperatura altera o equilíbrio. Se ela aumentar, deslocar-se-á no sentido da reação endotérmica, e se diminuir, deslocar-se-á no sentido da exotérmica.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
O ozônio é formado por meio da reação endotérmica:
3 O2(g) ↔ 2 O3(g)
Quando ocorre o aumento da temperatura, o que acontece com esse sistema?
-
O equilíbrio se desloca para direita e a formação do ozônio é favorecida.
-
O equilíbrio se desloca para esquerda e a formação do oxigênio é favorecida.
-
O equilíbrio se desloca para esquerda e a formação do ozônio é favorecida.
-
O equilíbrio se desloca para direita e a formação do oxigênio é favorecida.
-
O equilíbrio não se altera.
Alternativa “a”.
Se aumentarmos a temperatura do sistema, o equilíbrio químico será deslocado no sentido da reação endotérmica, que nessa reação é para a direita, no sentido de formação do ozônio. Isso ocorre para que o calor seja absorvido e se atinja novamente o equilíbrio.
-
-
Questão 2
A reação entre trióxido de enxofre e água ocorre na atmosfera, produzindo uma solução de ácido sulfúrico, causando a chuva ácida. Essa reação pode ser representada pelo equilíbrio abaixo:
SO3(g) + H2O(l)→ H2SO4(aq) ∆H < 0
Se a temperatura aumentar, o valor numérico da constante de equilíbrio:
-
Não se altera, porque tanto a concentração dos reagentes quanto a concentração dos produtos diminuem.
-
Não se altera, porque tanto a concentração dos reagentes quanto a concentração dos produtos aumentam.
-
Diminui.
-
Aumenta.
Alternativa “c”.
O valor de ∆H é negativo, o que significa que a reação direta ocorre com liberação de energia, ou seja, é exotérmica, e, consequentemente, a reação inversa é endotérmica (com absorção de energia). Se aumentarmos a temperatura do sistema, o equilíbrio químico será deslocado no sentido da reação endotérmica, que nessa reação é para a esquerda, no sentido de formação dos reagentes SO3(g) + H2O(l), aumentando a concentração deles.
Assim, pela expressão do Kc, temos:
↓ Kc = ↓[ H2SO4]2
↑[N2O4]Com isso, o valor de Kc diminuirá.
-
-
Questão 3
(UNB-DF) Os corais são encontrados somente em águas quentes. Um dos componentes dos corais, o carbonato de cálcio, CaCO3(s), coexiste em equilíbrio, segundo a equação:
CaCO3(s) + CO2(g) + H2O(ℓ) ↔ Ca(HCO3)2(aq)
Auxiliado por essas informações, julgue os itens a seguir em certos ou errados e justifique sua resposta.
0. Em mares frios, há muito CO2(g) dissolvido na água, e o equilíbrio acima se desloca para a direita, consumindo o CaCO3(s), um dos componentes dos corais;
1. Em mares quentes, há pouco CO2(g) dissolvido, provocando a dissolução do CaCO3(s);
2. Uma diminuição da concentração de CO2(g) sobre o equilíbrio citado irá favorecer a formação de corais.
0. Correto. A solubilidade dos gases é maior em baixas temperaturas. Com isso, o equilíbrio é deslocado para a direita, consumindo ainda mais CaCO3(s);
1. Incorreto. Como há pouco CO2(g), o CaCO3(s) é pouco dissolvido;
2. Correto. O equilíbrio será deslocado para a esquerda, favorecendo a formação de corais.
-
Questão 4
(Unifor-CE) São dados abaixo cinco valores de constantes de equilíbrio (Kc) para a reação:
N2O4(g) ↔ 2 NO2(g)
a diferentes temperaturas:
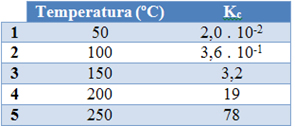
Qual das temperaturas favorece a decomposição do N2O4(g)?
a)1
b)2
c)3
d)4
e)5
Alternativa “e”.
Se a intenção é favorecer a decomposição de N2O4(g), o equilíbrio deve ser deslocado para a direita, ou seja, a concentração de N2O deve prevalecer:
N2O4(g) ↔ 2 NO2(g)
Assim, pela expressão do Kc, temos:
↑ Kc = ↑[ NO2]2
[N2O4]Quanto maior for o [NO2], maior será o Kc, o que se verifica a uma temperatura de 250 ºC.