Exercícios sobre concentração comum
Resolva esta lista de exercícios sobre concentração comum das soluções, uma das formas de se classificar quantitativamente uma solução.
Perguntas
Questão: 1
(Albert Einstein) Muitos atletas empregam em suas dietas um suplemento alimentar de proteína do soro do leite, denominado whey protein, comercializado na forma de pó, para ser misturado em água. Considere uma embalagem que contenha uma colher medidora e que apresente as seguintes instruções de preparo na forma do infográfico:
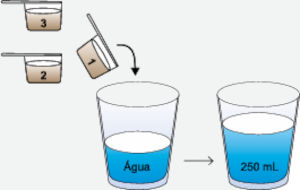
No preparo da bebida, são usadas 3 medidas de whey protein. Cada colher medidora contém 7,5 g de proteína.
A concentração em massa de proteína na bebida preparada de acordo com as instruções da embalagem é igual a
A) 30,0 g/L.
B) 63,5 g/L.
C) 22,5 g/L.
D) 7,5 g/L.
E) 90,0 g/L.
Questão: 2
(Unichristus) Uma solução foi preparada dissolvendo-se 12,0 g de cloreto de sódio (NaCl) em 3,0 litros de água.
Sabendo que o volume da solução permaneceu 3,0 L, qual é a concentração da solução final?
A) 2 g/L
B) 3 g/L
C) 4 g/L
D) 6 g/L
E) 8 g/L
Questão: 3
(UEMG) O rótulo de um suco em pó apresenta as seguintes informações:
|
Modo de preparo: Adicione o conteúdo deste pacote em 1 L de água gelada e misture bem. |
||
|
Informação nutricional |
Quantidade por porção. Valor energético 21 kcal = 88 kJ |
|
|
Porção de 6 g (1 colher de sopa) |
Carboidratos totais |
4,9 g |
|
Açúcares |
4,5 g |
|
|
Sódio |
32 mg |
|
|
Ferro |
2,1 mg |
|
|
Vit C |
6,8 mg |
|
|
Vit A |
90 µg RE |
|
Para preparar um suco, Clarice seguiu as orientações do rótulo do produto. Sabendo que a massa total de cada pacotinho de suco é de 25 g, calcule a quantidade de açúcar presente em um copo de 200 mL do suco preparado.
A) 3,75 g.
B) 4,5 g.
C) 18,75 g.
D) 112,5 g.
Questão: 4
(Fatec) Devido ao consumo exagerado de bebidas alcoólicas, vários problemas sociais e de saúde são ocasionados.
O etilômetro (bafômetro) é um aparelho que mede a concentração de etanol no sangue de uma pessoa mediante análise do ar expirado. A concentração em gramas por litro expressa a razão entre a massa do soluto dissolvido em um litro de solução. Considere que uma pessoa adulta, após ingerir 100 mL de vinho, submeteu-se ao teste do etilômetro.
Supondo que todo etanol ingerido esteja diluído no sangue, é correto afirmar que a concentração de etanol no sangue dessa pessoa, apresentada pelo etilômetro é, em g/L, aproximadamente,
Dados:
- concentração de etanol no vinho = 80,2 g /L
- uma pessoa adulta apresenta, em média, 5 L de sangue
A) 1,05.
B) 1,60.
C) 2,57.
D) 3,58.
E) 4,16.
Questão: 5
Uma solução de soro fisiológico deve ter 9 g/L para ser utilizada. Um técnico deseja preparar 200 mL de soro fisiológico para aplicar uma medicação intravenosa. Indique a massa de soluto, em gramas, necessária para preparar a solução de soro fisiológico.
A) 9.
B) 1,8.
C) 0,9.
D) 18.
E) 0,18.
Questão: 6
Para um ensaio em laboratório, um químico precisa preparar uma solução 1,5 g/L de hidróxido de sódio. Seu supervisor indicou que havia um frasco de hidróxido de sódio para esgotar no almoxarifado e solicitou que o químico utilizasse toda a massa lá contida. O químico então seguiu o indicado pelo supervisor e aferiu que havia 6 gramas de hidróxido de sódio no frasco. Que volume de água, em mililitros, o químico deve utilizar para produzir a solução corretamente?
A) 4.
B) 40.
C) 4000.
D) 9.
E) 9000.
Questão: 7
Um químico deseja preparar três soluções de cloreto de potássio, cada uma com 500 mL, com as respectivas concentrações: 0,5 g/L, 1 g/L e 2 g/L.
Determine a massa total de cloreto de potássio que o químico deve utilizar para preparar todas as soluções de cloreto de potássio.
A) 1,75 g.
B) 2,00 g.
C) 2,33 g.
D) 3,00 g.
E) 3,50 g.
Questão: 8
Determine a concentração de uma solução de permanganato de potássio, em g/L, que foi feita pela dissolução de 0,4 mg de soluto em 20 mL de água.
A) 2,0.
B) 0,2.
C) 0,02.
D) 0,002.
E) 0,0002.
Questão: 9
Para preparar 50 mL de um café, uma pessoa adiciona 0,4 g de açúcar branco, sacarose. A concentração, em g/L, de sacarose nesse café é igual a:
A) 0,4.
B) 0,05.
C) 8.
D) 0,02.
E) 2.
Questão: 10
Uma das recomendações da OMS para o tratamento de água é a adição de flúor por meio do fluoreto de sódio (NaF), em um processo conhecido como fluoretação da água. A concentração ideal de fluoreto de sódio na água é de 0,7 mg/L. Na estação de tratamento de águas do Guandu, são tratados cerca de 43 m3 de água por segundo, sendo considerada a maior estação de tratamento de águas do mundo. A fim de se manter a concentração ideal de fluoreto na água tratada, indique a massa de fluoreto de sódio, em gramas, que a estação do Guandu deve utilizar a cada segundo.
A) 30,1
B) 61,4
C) 43,0
D) 0,016
E) 0,7
Questão: 11
Estima-se que o Mar Morto, conhecido pelo sua alta concentração salina, tem cerca de 300 g/L. O seu volume total de água é de 114 km3. Determine a massa total de sal presente, em toneladas, no Mar Morto.
Dados: 1 km3 = 1,0 x 1012 L; 1 t = 1,0 x 106 g.
A) 3,42 x 104
B) 3,42 x 106
C) 3,42 x 108
D) 3,42 x 1010
E) 3,42 x 1012
Questão: 12
Soluções mais concentradas de soro para lavagem nasal têm sido vendidas nas farmácias com a concentração de 30 g/L. A fim de preparar um soro nasal concentrado em casa, uma pessoa decidiu utilizar 150 gramas de cloreto de sódio. Indique a alternativa que contém o volume de solução de soro para lavagem nasal que essa pessoa conseguirá preparar, em litros.
A) 1,0.
B) 2,0.
C) 3,0.
D) 4,0.
E) 5,0.
Respostas
Questão: 1
Alternativa E.
São usadas 3 medidas da bebida proteica, o que totaliza uma massa de 22,5 g de proteína.
O volume da solução é de 250 mL, ou 0,25 L.
Em g/L, a concentração é calculada da seguinte forma:
C=mVC=22,5g0,25LC=90g/L
Questão: 2
Alternativa C.
A concentração é calculada da seguinte forma:
C=mVC=12,0g3,0LC=4g/L
Questão: 3
Alternativa A.
Ao preparar o suco segundo as recomendações, Clarice dissolveu 25 gramas do suco em 1 litro de água, chegando à concentração de 25 g/L, possível de se calcular da seguinte forma:
C=mVC=25 g1 LC=25 g/L
Ocorre que Clarice tomou apenas um copo de 200 mL (0,2 L). Dessa forma, a massa de suco tomado por Clarice é calculada da seguinte forma:
C=mV25 g/L=m0,2 Lm=0,2⋅25m=5 g
Segundo os dados de informação nutricional, a cada 6 gramas de suco, há 4,5 gramas de açúcar, assim, proporcionalmente, há:
6 g suco ------------ 4,5 g açúcar
5 g suco ------------ x
6x = 5 ∙ 4,5
6x = 22,5
x = 3,75 g de açúcar.
Assim, em 200 mL de suco, Clarice consumiu 3,75 g de açúcar.
Questão: 4
Alternativa B.
A pessoa, ao ingerir 100 mL (0,1 L) de vinho, consumiu a seguinte massa de etanol:
C = m/V
80,2 g/L = m/0,1 L
m = 8,02 g de etanol
O etanol foi diluído no sangue, portanto, a concentração de etanol no sangue, cujo volume é de 5 L, é aproximadamente igual a:
C = m/V
C = 8,02 g/5 L
C = 1,604 g/L
C = 1,60 g/L
Questão: 5
Alternativa B.
A concentração comum é determinada pela fórmula C = m/V. O volume deve ser considerado em litros, pois a unidade é g/L. 200 mL são 0,2 L.
Substituindo os valores de concentração e volume, é possível determinar a massa de soluto:
9 = m/0,2
m = 1,8 g.
Questão: 6
Alternativa C.
A concentração comum é determinada pela fórmula C = m/V. O volume deve ser considerado em litros, portanto, o valor a ser encontrado deve ser convertido para mililitros.
Substituindo os valores de concentração e massa, é possível determinar o volume de solução:
1,5 = 6 / V
V = 6/1,5
V = 4 L
V = 4000 mL
Questão: 7
Alternativa A.
Pela fórmula C = m/V, determinamos a massa de cloreto de potássio em cada solução. O volume deve ser utilizado em litros, portanto, o volume é de 0,5 L.
Solução 1: 0,5 = m/0,5; m = 0,25 g.
Solução 2: 1,0 = m/0,5; m = 0,50 g.
Solução 3: 2,0 = m/0,5; m = 1,00 g.
A massa total de soluto é, então: 0,25 + 0,50 + 1,00 = 1,75 g.
Questão: 8
Alternativa C.
A concentração pode ser determinada pela expressão C = m/V. Contudo, a massa deve ser utilizada em gramas e o volume em litros. 0,4 mg são 0,0004 g, enquanto 20 mL são 0,02 L.
C = m/V
C = 0,0004/0,02
C = 0,02 g/L
Questão: 9
Alternativa C.
A concentração pode ser determinada pela fórmula C = m/V, porém o volume deve estar em litros, ou seja, 50 mL são 0,05 L.
C = m/V
C = 0,4 g/0,05 L
C = 8 g/L
Questão: 10
Alternativa A.
A concentração pode ser calculada pela fórmula C = m/V. Como a concentração é em mg/L, a massa é dada em mg e o volume está em litros. 43 m3 são iguais a 43.000 L. Assim sendo:
C = m/V
0,7 mg/L = m/43.000 L
m = 30.100 mg
m = 30,1 g.
Questão: 11
Alternativa D.
114 km3 são equivalentes a 114 ∙ 1012 L.
Pela fórmula C = m/V, achamos a massa de sal do Mar Morto.
300 g/L = m/114 ∙ 1012 L
m = 34.200 ∙ 1012 g = 3,42 ∙ 1016 g
Fazendo a conversão desse valor para toneladas, temos que a massa de sal do Mar Morto é de 3,42 ∙ 1010 t.
Questão: 12
Alternativa E.
A determinação do volume pode ser feita por meio da fórmula C = m/V.
30 g/L = 150 g/V
V = 150/30
V = 5,0 L
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-concentracao-comum.htm