Exercícios sobre Classificação das Bases
A classificação das bases pode ocorrer segundo três critérios: o número de hidroxilas, a solubilidade e a força ou dissociação iônica.
Perguntas
Questão: 1
Escreva as fórmulas das bases apresentadas abaixo e, em seguida, indique a solubilidade e a força de cada uma:
a) Hidróxido de lítio;
b) Hidróxido de potássio;
c) Hidróxido de cálcio;
d) Hidróxido de bário;
e) Hidróxido de ferro III;
f) Hidróxido de ferro II;
g) Hidróxido cuproso ou cobre I;
h) Hidróxido cúprico ou cobre II;
i) Hidróxido de amônia.
Dê os nomes das bases abaixo e classifique-as segundo os seguintes critérios: número de hidroxilas, força e solubilidade.
a) KOH
b) Zn(OH)2
c) Mg(OH)2
d) Ni(OH)3
e) Ca(OH)2
f) LiOH
g) Pb(OH)4
(Mack-SP) A tabela a seguir fornece a força e a solubilidade de bases em água:
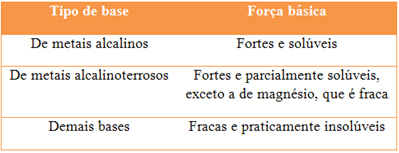
Para desentupir um cano de cozinha e para combater a acidez estomacal, necessita-se, respectivamente, de uma base forte e solúvel e de uma base fraca e parcialmente solúvel.
Consultando a tabela acima, conclui-se que as fórmulas dessas bases podem ser:
a) Ba(OH)2 e Fe(OH)3
b) Al(OH)3 e NaOH
c) KOH e Ba(OH)2
d) Cu(OH)2 e Mg(OH)2
e) NaOH e Mg(OH)2
(Osec-SP) Uma base forte deve ter ligado ao grupo OH-:
a) Um elemento muito eletropositivo.
b) Um elemento muito eletronegativo.
c) Um semimetal.
d) Um metal que dê três elétrons.
e) Um ametal.
Respostas
Questão: 1
a) Hidróxido de lítio: LiOH = solúvel, forte;
b) Hidróxido de potássio: KOH = solúvel, forte;
c) Hidróxido de cálcio: Ca(OH)2 = pouco solúvel, forte;
d) Hidróxido de bário: Ba(OH)2 = pouco solúvel, forte;
e) Hidróxido de ferro III: Fe(OH)3 = insolúvel, fraca;
f) Hidróxido de ferro II: Fe(OH)2 = insolúvel, fraca;
g) Hidróxido cuproso ou cobre I: CuOH = = insolúvel, fraca;
h) Hidróxido cúprico ou cobre II: Cu(OH)2 = insolúvel, fraca;
i) Hidróxido de amônia: NH4OH = solúvel, fraca.
a) KOH = hidróxido de potássio.
-Número de hidroxilas: monobase;
-Força: forte;
-Solubilidade: solúvel.
b) Zn(OH)2 = hidróxido de zinco.
-Número de hidroxilas: dibase;
-Força: fraca;
-Solubilidade: praticamente insolúvel.
c) Mg(OH)2 = hidróxido de magnésio.
-Número de hidroxilas: dibase;
-Força: fraca;
-Solubilidade: praticamente insolúvel.
d) Ni(OH)3= hidróxido de níquel III ou hidróxido niquélico.
-Número de hidroxilas: tribase;
-Força: fraca;
-Solubilidade: praticamente insolúvel.
e) Ca(OH)2 = hidróxido de cálcio.
-Número de hidroxilas: dibase;
-Força: forte;
-Solubilidade: parcialmente insolúvel.
f) LiOH = hidróxido de lítio.
-Número de hidroxilas: monobase;
-Força: forte;
-Solubilidade: solúvel.
g) Pb(OH)4 =hidróxido de chumbo IV ou hidróxido plúmbico.
-Número de hidroxilas: tetrabase;
-Força: fraca;
-Solubilidade: praticamente insolúvel.
Questão: 3
Alternativa “e”. O hidróxido de sódio é uma base forte utilizada no desentupimento de canos. O hidróxido de magnésio é uma base fraca utilizada para combater a acidez estomacal, da mesma forma que o hidróxido de alumínio.
Questão: 4
Alternativa “a”. As bases mais fortes são principalmente as que contêm metais alcalinos, pois os elementos desse grupo são muito eletropositivos. Por serem muito eletropositivos, esses elementos têm a tendência de ficar em solução na forma catiônica ( Na+, K+, etc. ) e, com isso, liberam OH- muito facilmente, o que configura uma base forte.
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-classificacao-das-bases.htm