Exercícios sobre o Princípio de Le Chatelier
O Princípio de Le Chatelier diz que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá se deslocar de forma a minimizar tal perturbação.
Perguntas
Questão: 1
Observe o seguinte equilíbrio:
2 SO2(g) + O2(g) ↔ 2 SO3(g) ∆H < 0
Marque a(s) alternativa(s) que causariam a diminuição da constante de equilíbrio (Kc):
-
Quando se aumenta a concentração do dióxido de enxofre.
-
Quando se diminui a concentração do trióxido de enxofre.
-
Quando se aumenta a pressão do sistema.
-
Quando se aumenta a temperatura do sistema.
-
Quando se diminui a temperatura do sistema.
Questão: 2
Considerando o equilíbrio
2 H2S(g) + 3 O2(g) ↔ 2 H2O(g) + 2 SO2(g) ∆H = -1036 kJ
e seguindo o Princípio de Le Chatelier, coloque a letra “E” nas alternativas em que o equilíbrio químico é deslocado para a esquerda e “D” quando ele é deslocado para a direita:
-
( ) diminui-se a temperatura do sistema.
-
( ) aumenta-se a pressão do sistema.
-
( ) adiciona-se dióxido de enxofre ao sistema.
-
( ) retira-se gás oxigênio do sistema.
-
( ) adiciona-se um gás inerte ao sistema, sem alterar o volume do sistema.
(Cesgranrio-RJ) O gráfico seguinte refere-se ao sistema químico
H2(g) + I2(g) ↔ 2 HI(g)
ao qual se aplica o Princípio de Le Chatelier.
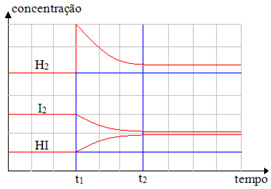
Analise o gráfico e indique a opção correta:
-
A adição de I2(g) em t1 aumentou a concentração de HI(g).
-
A adição de H2(g) em t2 aumentou a concentração de I2(g).
-
A adição de H2(g) em t2 levou o sistema ao equilíbrio.
-
A adição de H2(g) em t1 aumentou a concentração de HI(g).
-
A adição de HI(g) em t2 alterou o equilíbrio do sistema.
(UEPI) É muito comum as donas de casa, após a limpeza do peixe, usarem limão para remover o cheiro deixado em suas mãos. A maioria delas não tem uma explicação científica para o fato. Entretanto, sabe-se que o cheiro é causado pelo composto metilamina, de fórmula CH3 – NH2, cuja equação de equilíbrio é representada a seguir:
CH3 ─ NH2(aq) + H2O(l) ↔ CH3 ─ NH3(aq)+ + OH–(aq)
Segundo o Princípio de Le Chatelier, o cheiro desaparece porque:
a) A adição do limão (H+) neutraliza íons OH– , deslocando o equilíbrio para a direita, consumindo a metilamina.
b) A adição do limão (H+) neutraliza o íon OH–, deslocando o equilíbrio para a direita, consumindo o CH3 ─ NH3+.
c) A adição do limão (H+) neutraliza o íon, deslocando o equilíbrio para a esquerda, formando solução aquosa.
d) A adição do limão (H+) neutraliza o íon OH–, deslocando o equilíbrio para a esquerda, retirando a metilamina.
e) A adição do limão (H+) neutraliza o íon OH–, deslocando o equilíbrio para a esquerda, diminuindo a concentração de H2O.
Respostas
Questão: 1
Alternativa “d”.
As alternativas a, b e c estão incorretas porque qualquer variação da concentração dos reagentes ou dos produtos e da pressão do sistema não afeta a constante de equilíbrio, ela depende unicamente da temperatura.
A alternativa “c” está correta porque o ∆H é menor que zero, sendo a reação direta exotérmica e a inversa endotérmica:
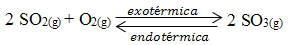
Kc = __[ SO3]2__
[SO2] . [O2]2
Portanto, se aumentarmos a temperatura, seguindo o Princípio de Le Chatelier, o equilíbrio se deslocará no sentido da reação que irá absorver calor, isto é, a endotérmica, que é a reação inversa. Com isso, a concentração do SO3 irá diminuir. Visto que Kc é diretamente proporcional ao [SO3], seu valor diminuirá.
A alternativa “e” está incorreta, porque quando a temperatura do sistema é diminuída, ocorre o inverso do que se acabou de explicar, o deslocamento será no sentido direto, favorecendo a reação exotérmica que libera calor. O valor de SO3 irá aumentar e, consequentemente, o Kc também.
Questão: 2
- (D) Visto que o ∆H é negativo, a reação direta é exotérmica e a inversa é endotérmica. Assim, quando se diminui a temperatura do sistema, ele segue o Princípio de Le Chatelier e desloca-se para o sentido da reação exotérmica que irá liberar calor, ou seja, para a direita.
- (D) Se aumentarmos a pressão, o equilíbrio será deslocado no sentido de menor volume. Os reagentes possuem 5 volumes (2 moléculas de H2S(g) e 3 moléculas de O2(g)) e os produtos possuem 4 volumes (2 moléculas de H2O(g) e 2 moléculas de SO2(g)). Portanto, o equilíbrio se desloca para o sentido dos produtos, para a direita.
- (E) Com o aumento da concentração [SO2], o equilíbrio é deslocado no sentido do consumo dessa substância, que é para a esquerda.
- (E) Com a diminuição da concentração [O2], o equilíbrio é deslocado no sentido de sua formação, ou seja, para a esquerda.
- Nesse caso, o equilíbrio não se desloca.
Alternativa “d”.
Em t1, o único que teve o valor da concentração aumentada foi o H2(g). Seguindo então o Princípio de Le Chatelier, o equilíbrio deslocou-se no sentido do seu consumo, que é o direto, sendo que ele passou a reagir com o I2(g), produzindo o HI(g). Por isso, a concentração do HI(g) aumentou, enquanto as concentrações de H2(g) e I2(g) diminuíram.
Questão: 4
Alternativa “a”.
A adição do limão (H+) neutraliza íons OH–, aumentando a concentração da água (H2O(l)), que irá seguir o princípio de Le Chatelier e reagir com a metilamina (que é o composto responsável pelo cheiro deixado pelo peixe nas mãos). Com isso, o equilíbrio será deslocado para a direita.
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm