Exercícios sobre Pilha Seca de Leclanché
A pilha seca de Leclanché possui um invólucro de zinco que funciona como o ânodo, e o cátodo é um eletrodo central formado por um bastão de grafita.
Perguntas
Questão: 1
As pilhas comuns de lanternas, brinquedos, entre outros, são chamadas de Leclanché ou pilhas secas. Em relação a essas pilhas, identifique a alternativa incorreta:
- A substância despolarizante, isto é, que evita a polarização, é o dióxido de manganês.
- O polo negativo (ânodo) dessa pilha é um envoltório de zinco.
- O bastão de grafite instalado no centro dessa pilha funciona como polo positivo (cátodo).
- Ela é uma pilha recarregável.
- Essas pilhas são chamadas também de pilhas ácidas porque contêm cloreto de amônio e cloreto de zinco, que são sais de caráter ácido.
Quando uma pilha seca comum para de funcionar, algumas pessoas colocam-na na geladeira e observam que após certo tempo ela volta a funcionar. Isso acontece porque:
- A baixa temperatura ajuda a recarregar essas pilhas.
- A baixa temperatura faz com que o gás amônia descubra o eletrodo de grafite.
- A baixa temperatura favorece a produção de MnO2, que atua como despolarizante.
- A baixa temperatura favorece a perda de elétrons do ânodo.
- A baixa temperatura favorece as reações reversíveis que ocorrem no cátodo e no ânodo.
(PUCCamp - SP) Nas pilhas secas, geralmente utilizadas em lanternas, há um envoltório de zinco metálico e um bastão central de grafite rodeado de dióxido de manganês e pasta úmida de cloreto de amônio e de zinco, conforme a figura a seguir.

As reações são complexas, porém, quando o fluxo de corrente é pequeno, as reações podem ser apresentadas por:
Ânodo: 1 Zn → 2 e- + 1 Zn2+
Cátodo: 2 MnO2+ 2 NH41+ + 2e- → Mn2O3(s) + 2 NH3 + H2O
À medida que a pilha seca vai sendo gasta, há aumento nas massas de:
a) zinco metálico e água.
b) dióxido de manganês.
c) sais de amônio e de zinco.
d) zinco metálico e dióxido de manganês.
e) amônia, água, sais de zinco e óxido de manganês III.
Questão: 4
(UnB-DF) As pilhas vendidas no comércio para uso em lanternas, rádios e outros aparelhos elétricos constituem-se fundamentalmente de uma cápsula de zinco, uma solução aquosa de eletrólitos (ZnCl2 + NH4Cl), dióxido de manganês e um bastão de grafita.
A figura a seguir representa um corte longitudinal de uma pilha de manganês.
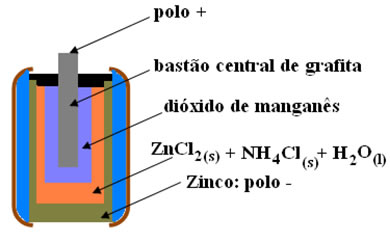
Durante o funcionamento da pilha, ocorrem as seguintes reações:
No ânodo: Zn(s) → Zn2+(aq) + 2 e-
No cátodo: 2 MnO2(s) + 2 NH41+(aq) + 2e- → Mn2O3(s) + 2 NH3(aq) + H2O(ℓ)
Julgue os itens a seguir:
- Mn4+ é o agente redutor.
- Durante o funcionamento dessa pilha, o fluxo de elétrons ocorre no sentido grafita → zinco.
- A reação global da pilha é:
Zn(s) + Mn2O3(s) + 2 NH3(aq) + H2O(ℓ) → Zn2+(aq) + 2 MnO2(s) + 2 NH41+(aq) + 4e-
- A quantidade de Zn2+ diminui durante o funcionamento da pilha.
- A pilha cessará seu funcionamento quando o MnO2 for totalmente consumido.
Respostas
Questão: 1
Alternativa “d”.
Uma vez esgotadas, as pilhas secas não podem ser recarregadas para novo uso, ao contrário das baterias de chumbo.
Questão: 2
Alternativa “b”.
No cátodo dessa pilha ocorre a seguinte reação:
Cátodo: 2 MnO2(aq) + 2 NH4 1+ (aq) + 2e- → 1 Mn2O3 (s) + 2 NH3(g) + 1 H2O(l)
A amônia (NH3(g)) formada no cátodo pode se depositar sobre a barra de grafita, dificultando a passagem dos elétrons e diminuindo a voltagem da pilha. Para voltar ao funcionamento normal, basta deixar a pilha em repouso fora do aparelho, pois o cátion zinco (Zn2+ (aq)) formado no ânodo reage com a amônia, deixando a barra de grafita livre.
Além disso, colocar a pilha na geladeira também pode ajudar, pois a diminuição da temperatura favorece a solubilidade da amônia na pasta úmida da pilha.
Questão: 3
Alternativa “e”.
Conforme mostram as reações, à medida que a pilha funciona, formam-se como produtos no cátodo: Mn2O3(s), NH3 e H2O; e no ânodo: Zn2+ (que constitui os sais de zinco).
Questão: 4
Apenas o item 4 está correto.
- Errado. O agente redutor é o Zn0.
Fazendo a somatória dos dois eletrodos, temos a reação global:
Zn0(s) ↔ Zn2+(aq) + 2 e-
2 MnO2(s) + 2 NH41+(aq) + 2e- ↔ Mn2O3(s) + 2 NH3(aq) + H2O(ℓ)
Zn0(s) + 2 MnO2(s) + 2 NH41+(aq) ↔ Zn2+(aq) + Mn2O3(s) + 2 NH3(aq) + H2O(ℓ)
Zn0(s) → oxidação → Zn2+(aq)
Mn4+ (MnO2(s)) → redução → Mn3+( Mn2O3(s))
Zn0(s) → agente redutor
MnO2(s)→ agente oxidante
- Errado. O fluxo de elétrons ocorre no sentido do zinco para a grafita.
- Errado. A reação total da pilha é a resolução da somatória dos dois eletrodos acima.
- Errado. A quantidade de Zn2+ aumentará em virtude da perda de elétrons durante o funcionamento da pilha.
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-pilha-seca-leclanche.htm