Exercícios sobre Pressão Osmótica
A pressão osmótica é simbolizada por π e corresponde à pressão externa que deve ser aplicada para parar o processo de osmose. Seu cálculo é dado por: π = M . R . T . i.
Perguntas
Questão: 1
Considere que a concentração do cloreto de sódio na água do mar seja de aproximadamente 0,4 mol/L. Qual será a pressão que deve ser aplicada para dessalinizar a água do mar a 27 ºC, desconsiderando as outras substâncias dissolvidas. (Dado R = 0,082 atm . L . K-1 , mol-1).
-
1,77 atm
-
9,84 atm
-
0,88 atm
-
19,7 atm
-
17 atm
Considere os seguintes compostos abaixo em água, estando 100% dissociados e todos em mesma temperatura:
- NaCℓ 1,0 mol/L
- Na3PO4 0,5 mol/L
- AℓCℓ3 1,0 mol/L
- Sacarose 1,0 mol/L
- MgCℓ2 1,0 mol/L
Qual a ordem crescente de pressão osmótica das soluções formadas pelas substâncias acima:
-
I < II < III < IV < V.
-
II < V < III = IV < I.
-
V < IV < III < II < I.
-
IV < I = II < V < III.
-
III = II < IV < I < V.
(FUC-MT) Na desidratação infantil aconselha-se a administração de soro fisiológico para reequilibrar o organismo. Quando injetado nas veias, este soro deve:
a) ser isotônico em relação ao sangue.
b) ser hipertônico em relação ao sangue.
c) ser hipotônico em relação ao sangue.
d) ter pressão osmótica maior do que a do sangue.
e) ter pressão osmótica menor do que a do sangue.
Questão: 4
(PUC-SP) Os medicamentos designados por A,B,C e D são indicados para o tratamento de um paciente. Adicionando-se água a cada um desses medicamentos, obtiveram-se soluções que apresentam as seguintes propriedades:
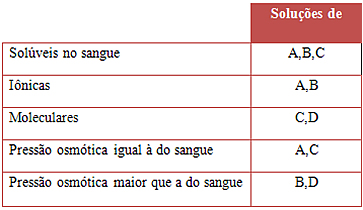
Assinale a alternativa que só contém os medicamentos que poderiam ser injetados na corrente sanguínea sem causar danos.
-
A, B, C e D
-
A, B e D
-
B, C e D
-
B e D
-
A e C
Respostas
Questão: 1
Alternativa “e”.
Devemos primeiro descobrir o valor do fator de Van’t Hoff (i) para o cloreto de sódio, que é a quantidade de partículas produzidas por fórmula de soluto:
1 NaCℓ → 1 Na+ + 1 Cℓ-
Veja que 1 fórmula de NaCℓ gera dois íons, por isso o valor de i é 2.
Temos também que passar a temperatura para a escala absoluta:
T(K) = T (ºC) + 273
T(K) = 27 + 273
T(K) = 300 K
Agora podemos substituir os valores na fórmula abaixo e descobrir a pressão osmótica:
π = M . R . T . i.
π = (0,4 mol/L) . (0,082 atm . L . K-1 , mol-1) . (300 K) . (2)
π = 19,68 atm
Questão: 2
Alternativa “d”.
Vamos determinar a relação das pressões osmóticas das soluções acima, considerando que a constante universal dos gases (R) e a temperatura não interferem, pois são as mesmas para todos os casos:
- 1 NaCℓ → 1 Na+ + 1 Cℓ-
π = M . R . T . i. → π = 1,0 . R . T . 2 → π = 2,0 . R . T - 1 Na3PO4→ 3 Na+ + 1 PO4-3
π = M . R . T . i. → π = 0,5 . R . T . 4 → π = 2,0 . R . T - 1 AℓCℓ3 → 1 Aℓ+3 + 3 Cℓ-
π = M . R . T . i. → π = 1,0 . R . T . 4 → π = 4,0 . R . T - Sacarose 1,0 mol/L – molecular, não forma íons, então não usa o fator de Vant’ Hoff: π = 1,0 . R . T
- MgCℓ2→ 1 Mg+2 + 2 Cℓ-
π = M . R . T . i. → π = 1,0 . R . T . 3 → π = 3,0 . R . T
Assim, temos a seguinte ordem crescente de pressão osmótica:
Sacarose < NaCℓ = Na3PO4 < MgCℓ2 < AℓCℓ3
ou
IV < I = II < V < III.
Questão: 3
Alternativa “a”.
Questão: 4
Alternativa “e”.
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-pressao-osmotica.htm