Exercícios sobre Mol e Número de Avogadro
Estes exercícios sobre mol e número de Avogadro exigem que se conheça a relação que estabelece que 1 mol de qualquer substância apresenta 6,0 . 1023 partículas constituintes.
Perguntas
Questão: 1
Sabendo que a massa atômica do magnésio é igual a 24 u, determine a massa, em gramas, de um átomo desse elemento. (Dado: Número de Avogadro = 6,0 . 1023).
a) 24 g.
b) 4,0 g.
c) 24 . 10-23 g.
d) 4,0 . 1023 g.
e) 4,0 . 10-23 g.
Questão: 2
Considere um copo que contém 180 mL de água. Determine, respectivamente, o número de mol de moléculas de água, o número de moléculas de água e o número total de átomos (Massas atômicas = H = 1,0; O = 16; Número de Avogadro = 6,0 . 1023; densidade da água =1,0 g/mL).
a) 10 mol, 6,0 . 1024 moléculas de água e 18 . 1024 átomos.
b) 5 mol, 6,0 . 1024 moléculas de água e 18 . 1024 átomos.
c) 10 mol, 5,0 . 1023 moléculas de água e 15 . 1024 átomos.
d) 18 mol, 6,0 . 1024 moléculas de água e 18 . 1024 átomos.
e) 20 mol, 12 . 1024 moléculas de água e 36 . 1024 átomos.
Questão: 3
(UNB) Os microprocessadores atuais são muito pequenos e substituíram enormes placas contendo inúmeras válvulas. Eles são organizados de forma que apresentem determinadas respostas ao serem percorridos por um impulso elétrico. Só é possível a construção de dispositivos tão pequenos devido ao diminuto tamanho dos átomos. Sendo estes muito pequenos, é impossível contá-los. A constante de Avogadro - e não o número de Avogadro - permite que se calcule o número de entidades - átomos, moléculas, formas unitárias, etc. - presentes em uma dada amostra de substância. O valor dessa constante, medido experimentalmente, é igual a 6,02 . 1023 mol-1. Com relação ao assunto, julgue os seguintes itens.
(01) A constante de Avogadro é uma grandeza, sendo, portanto, um número (6,02 . 1023) multiplicado por uma unidade de medida (mol-1).
(02) A constante de Avogadro, por ser uma grandeza determinada experimentalmente, pode ter seu valor alterado em função do avanço tecnológico.
(03) Massas iguais de diferentes elementos químicos contêm o mesmo número de átomos.
(04) Entre os elementos químicos, o único que, em princípio, não está sujeito a uma variação de massa atômica é o isótopo do carbono de massa 12,00 u.
Questão: 4
(Fuvest-SP) A tabela abaixo apresenta o mol, em gramas, de várias substâncias:
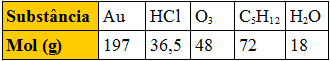
Tabela com mol de substâncias
Comparando massas iguais dessas substâncias, a que apresenta maior número de moléculas é:
a) Au
b) HCl
c) O3
d) C5H10
e) H2O
Respostas
Questão: 1
Alternativa “e”.
1 mol de átomos de Mg ↔ 24 g/mol ↔ 6,0 . 1023 átomos/mol
x = 1 átomo . 24 g/mol
6,0 . 1023 átomos/mol
x = 4,0 . 10-23 g.
Questão: 2
Alternativa “a”.
A massa molar da água é igual a 18 g/mol. Visto que a densidade da água é igual a 1,0 g/mL, em 180 mL de água, temos 180 g:
d = m
v
m = d . v
m = (1,0 g/mL) . 180 mL
m = 180 g
Assim, temos:
1 mol de moléculas de água ------ 18 g/mol
n --------------------- 180 g
n = 180/18
n = 10 mol de moléculas de água
* Agora vamos determinar o número de moléculas de água:
18 g/mol ------- 6,0 . 1023 moléculas/mol
180 g----------- x
x = 180 . 6,0 . 1023
18
x = 60 . 1023 = 6,0 . 1024 moléculas de água.
* Determinação da quantidade total de átomos:
1 molécula de água (H2O) ----- 3 átomos
6,0 . 1024 moléculas/mol ------ y
y = (6,0 . 1024 ) . 3
y = 18,0 . 1024 átomos
Questão: 3
(01) Verdadeiro.
(02) Verdadeiro.
(03) Falso. Os átomos de diferentes elementos químicos possuem massas atômicas diferentes. Assim, se pegarmos massas iguais de diferentes elementos químicos, o número de átomos de cada elemento químico nessas massas será diferente (comparando massas iguais, quanto menor a massa atômica do elemento, maior o número de átomos desse elemento nessa massa).
(04) Verdadeiro.
Questão: 4
Alternativa “e”.
De acordo com a constante de Avogadro, terá maior número de moléculas a substância que tiver a maior quantidade de mols. Considerando que a quantidade de mols pode ser obtida por m/M, concluímos que, em igualdade de massa (m), a substância que tiver menor massa molar (M) terá maior número de moléculas. A que tem menor massa molar é a água (H2O).
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-mol-numero-avogadro.htm