Exercícios sobre entalpia
Exercícios sobre entalpia (energia interna que as moléculas de uma substância possuem) e sobre a variação da entalpia (ΔH) de processos endotérmicos e exotérmicos.
Perguntas
Questão: 1
(UFSM-RS) Considere o seguinte gráfico:
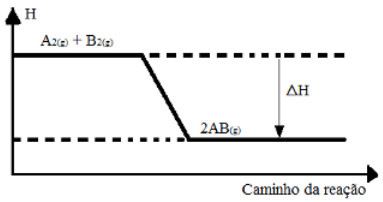
Gráfico de variação de entalpia de uma reação genérica
De acordo com o gráfico acima, indique a opção que completa, respectivamente, as lacunas da frase a seguir:
“A variação da entalpia,>ΔH, é ........; a reação é .......... porque se processa ............... calor.”
a) positiva, exotérmica, liberando
b) positiva, endotérmica, absorvendo
c) negativa, endotérmica, absorvendo
d) negativa, exotérmica, liberando
e) negativa, exotérmica, absorvendo
(Fuvest-SP) Quando 0,500 mol de etanol líquido sofre combustão total sob pressão constante, produzindo CO2 e H2O gasosos, a energia liberada é de 148 kcal. Na combustão de 3,00 mol de etanol, nas mesmas condições, a entalpia dos produtos, em relação à dos reagentes, é:
a) 74 kcal menor.
b) 444 kcal maior.
c) 444 kcal menor.
d) 888 kcal maior.
e) 888 kcal menor.
Resolução da questã
Questão: 3
Analise as reações termoquímicas a seguir com os seus respectivos valores de variação de entalpia e classifique-as como endotérmicas ou exotérmicas:
a) CO(g) + ½ O2(g) → CO2(g) >ΔH = -282,6 kJ
b) S(rômbico) + O2(g) → SO2(g) >ΔH = -296,6 kJ
c) H2(g) + ½ O2(g) → H2O(g) >ΔH = -241,6 kJ
d) N2(g) + O2(g) → 2 NO(g) >ΔH = +179,7 kJ
e) Na(s) + H2O(l) → NaOH(aq) + ½ H2(g) >ΔH = -140 kJ
Questão: 4
Qual será o calor absorvido na reação a seguir quando a quantidade de carbono for igual a 36 g?
SnO2(g) + 2 C(grafite) → Sn(s) + 2 CO(g) >ΔH = 360 kJ
a) 360 kJ.
b) 480 kJ.
c) 540 kJ.
d) 720 kJ.
e) 1080 kJ.
Respostas
Questão: 1
Alternativa “d”.
Pelo gráfico podemos ver que a entalpia do produto é menor que a dos reagentes, o que significa que houve liberação de energia na forma de calor e a reação é exotérmica. Assim, a frase fica da seguinte forma:
“A variação da entalpia, >ΔH, é negativa; a reação é exotérmica porque se processa liberando calor.”
Questão: 2
Alternativa “e”.
A combustão de 0,500 mol de etanol liberou 148 kcal. Visto que a entalpia de formação de uma substância é proporcional ao seu número de mol, podemos realizar uma regra de três para descobrir a variação de entalpia na combustão de 3,00 mol de etanol:
0,500 mol ------- 148 kcal
3,00 mol ------ >ΔH
>ΔH = 3,00 mol . 148 kcal
0,0500 mol
>ΔH = 888 kcal.
Alternativa “c”.
As reações exotérmicas possuem o >ΔH negativo e as endotérmicas possuem o >ΔH positivo. Assim, temos:
Exotérmicas: “a”, “b”, “c” e “e”.
Endotérmica: Somente a “d”.
Questão: 4
Alternativa “c”.
Pela reação verificamos que 2 mols de carbono são responsáveis por 360 kJ de calor da reação. Podemos então aplicar esta regra de três:
12 g é a massa de 1 mol de carbono
36 g será a massa de ?
12 g ------ 1 mol
36 g----------- x
x = 36 . 1
12
x = 3 mol de carbono
Como 3 mols constituem 1,5 multiplicado pela quantidade de matéria apresentada pelo carbono, o calor da reação aumenta proporcionalmente a esse valor:
>ΔH = 1,5 . 360 kJ
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-entalpia.htm