Exercícios sobre entalpia de neutralização
Estes exercícios sobre entalpia de neutralização exigem conhecimentos sobre a definição desse calor de reação, como ele pode ser calculado e o tipo de reação que o define.
Perguntas
Questão: 1
(UFRGS) A reação de neutralização entre um ácido forte e uma base forte libera uma quantidade de calor constante e igual a 58 kJ por mol de H2O formado. Das reações representadas a seguir, apresenta ∆H = -58 kJ/mol a reação:
a) NH4OH + HCl → NH4Cl + H2O
b) H2S + NaOH → NaHS + H2O
c) KOH + HCl → KCl + H2O
d) H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O
e) HCN + CuOH → CuCN + H2O
Questão: 2
A partir da reação:
H+(aq) + OH-(aq) → H2O(l) ∆H = - 57,7 kJ/mol
reagimos 2 mol de HCl e 2 mol de KOH, ambos eletrólitos fortes. Qual será o calor liberado ou absorvido nessa reação?
a) Libera 57,7 kJ.
b) Absorve 57,7 kJ.
c) Libera 28,85 kJ.
d) Libera 115,4 kJ.
e) Absorve 115,4 kJ.
Questão: 3
Qual das reações a seguir permite definir entalpia de neutralização?
a) 2 HCl(aq) + 2 NaOH(aq) → 2 NaCl(aq) + 2 H2O(l)
b) 3 HCN(aq) + 3 NaOH(aq) → 3 NaCN(aq) + 3 H2O(l)
c) ½ H2SO4(aq) + NaOH(aq) →½ Na2SO4(aq) + H2O(l)
d) H2S(aq) + 2 NaOH(aq) → Na2S(aq) + 2 H2O(l)
e) 1 H2SO4(aq) + 2 KOH(aq) → 1 K2SO4(aq) + 2 H2O(l)
Questão: 4
(PUC-RIO-2007) Considere calor de neutralização como a variação de entalpia na reação de um mol de H+ com um mol de OH-, formando um mol de H2O. Um experimento envolveu a reação de 2,00 g de NaOH contidos em solução aquosa de hidróxido de sódio com HCl suficiente para reação completa, contido em solução aquosa de ácido clorídrico, representada na equação abaixo:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Um estudante, usando os valores obtidos no experimento e a expressão Q = m.c.∆T, encontrou para essa reação a liberação de 660 cal. Sabendo-se que 1 cal equivale a 4,18 J, é correto afirmar que a variação de entalpia de neutralização, em kJ mol-1, é, de acordo com os algarismos significativos dos valores medidos, igual a:
a) 13,2.
b) 26,4.
c) 55,2.
d) 110.
Respostas
Questão: 1
Alternativa “c”.
a) NH4OH + HCl → NH4Cl + H2O
Reação entre base fraca e ácido forte.
b) H2S + NaOH → NaHS + H2O
Reação entre ácido fraco e base forte.
c) KOH + HCl → KCl + H2O
Reação entre base forte e ácido forte, liberando 1 mol de água. Essa é a opção correta.
d) H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O
Reação entre ácido forte e base forte. Porém, há 2 mols de água liberada.
e) HCN + CuOH → CuCN + H2O:
Reação entre ácido fraco e base fraca
Alternativa “d”.
As reações de neutralização sempre liberam calor, sendo exotérmicas, e a entalpia (energia global do sistema, ∆H) sempre é negativa, ou seja, menor que zero.
Reagindo 1 mol de HCl com 1 mol de KOH, são liberados 57,7 kJ:
1 HCl + 1 KOH → 1 KCl + 1 H2O(l) ∆H = - 57,7 kJ/mol
Então, se reagirmos 2 mol de HCl e 2 mol de KOH, a quantidade de energia liberada será o dobro de 57,7 kJ, isto é, 115,4 kJ.
2 HCl + 2 KOH → 2 KCl + 2 H2O(l) ∆H = - 115,4 kJ/mol
Alternativa “c”.
Essa é a única das reações apresentadas que define a entalpia de neutralização, que é o calor liberado na formação de 1 mol de água a partir da reação entre 1 mol de cátions hidrogênio com 1 mol de ânions hidroxila. Veja:
½ H2SO4(aq) + NaOH(aq) →½ Na2SO4(aq) + H2O(l)
É o mesmo que:
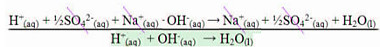
Reação que define entalpia de neutralização
Alternativa “c”.
A massa molar do NaOH é = 23 + 16 + 1 = 40 g/mol.
Vamos descobrir quantos mols reagiram, pois foram usados apenas 2 g de NaOH:
40 g----- 1 mol
2 g ------ x
x = 0,05 mol
Agora vamos passar a energia liberada de cal para kJ:
1 cal ---- 4,18 J
660 cal --- y
y = 2758,8 J
1 kJ ---- 1000 J
w ------ 2758,8 J
w = 2,7588 kJ
Mas a energia liberada foi para 0,05 mol. Precisamos descobrir a variação de entalpia de neutralização em kJ/mol:
2,7588 kJ------ 0,05 mol
z -------- 1 mol
z = 55,2 kJ/mol.
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-entalpia-neutralizacao.htm