Exercícios sobre momento dipolar resultante
Estes exercícios sobre momento dipolar resultante exploram a identificação do momento dipolar, a polaridade e a geometria molecular de compostos.
Perguntas
Questão: 1
Dadas as substâncias abaixo, marque a alternativa que apresenta as moléculas cujo momento dipolar resultante é igual à zero.
a)H2O e NH3
b) HCl e CH4
c) CO2 e CCl4
d) O2 e CHCl3
e) CO2 e H2O
Questão: 2
Sabe-se que uma substância pode ser solúvel em outra, principalmente quando suas moléculas apresentam polaridade semelhante, ou seja, polar com polar ou apolar com apolar (semelhante dissolve semelhante). Assim, a partir dessa informação, qual das moléculas abaixo poderia ser dissolvida com maior facilidade em água?
a) CO2
b) CH4
c) I2
d) HCl
e) Cl2
Questão: 3
(UFRGS RS) O momento dipolar é a medida quantitativa da polaridade de uma ligação. Em moléculas apolares, a resultante dos momentos dipolares referentes a todas as ligações apresenta valor igual a zero. Entre as substâncias covalentes abaixo,
I. CH4
II. CS2
III. HBr
IV. N2
Quais as que apresentam a resultante do momento dipolar igual a zero?
a) apenas I e II
b) apenas II e III
c) apenas I, II e III
d) apenas I, II e IV
e) I, II, III e IV
Questão: 4
(UESPI) Em relação aos compostos apresentados a seguir, quais não apresentam momento dipolar permanente, e são, portanto, moléculas apolares? Dados de número atômico: H = 1; Be = 4; B = 5; C = 6; N = 7; O = 8; F = 9; H = 1;Cl = 17.
1) H2O
2) NH3
3) CO2
4) BF3
5) BeCl2
Estão corretas apenas:
a) 1 e 2
b) 3 e 5
c) 1, 2 e 3
d) 2, 3 e 4
e) 3, 4 e 5
Respostas
Questão: 1
Letra c). A resposta é a letra c porque para ter momento dipolar resultante igual a zero, a molécula deve apresentar apenas dois átomos iguais (como no caso do O2, pois apresentam a mesma eletronegatividade) ou a anulação de todos os vetores. Abaixo temos a explicação de cada molécula:
A molécula de água apresenta geometria angular e dois vetores diagonais em direção ao oxigênio, por ele ser mais eletronegativo. Esses vetores diagonais devem ser obrigatoriamente decompostos (de acordo com a regra do paralelogramo), o que faz surgir o vetor resultante na vertical. Como a molécula apresenta apenas um vetor, o vetor momento dipolar resultante não pode ser igual a zero.
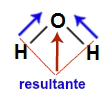
Vetores na estrutura da água
A molécula do metano (CH4) apresenta geometria tetraédrica e quatro vetores (sendo dois horizontais e dois verticais) em direção ao carbono, por ele ser mais eletronegativo. Os dois vetores verticais são somados por apresentar mesmo sentido, o que ocorre com os vetores horizontais. Porém, os vetores diagonais anulam os dois verticais por apresentarem direções diferentes. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero.
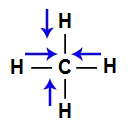
Vetores na estrutura do metano
A molécula do gás carbônico (CO2) apresenta geometria linear e dois vetores horizontais em direção aos átomos de oxigênio, por ele ser mais eletronegativo. Os dois vetores são anulados por apresentar sentidos diferentes. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero.
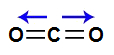
Vetores na estrutura do gás carbônico
A molécula do triclorometano (CHCl3) apresenta geometria tetraédrica e quatro vetores (sendo dois horizontais e dois verticais), sendo três em direção ao cloro, por ele ser mais eletronegativo que o carbono, e um em direção ao carbono, por ele ser mais eletronegativo que o hidrogênio. Os dois vetores verticais são anulados por apresentar sentidos diferentes, enquanto que os vetores horizontais são somados por apresentarem o mesmo sentido. Como a molécula apresenta apenas um vetor, o vetor momento dipolar resultante não é igual a zero.
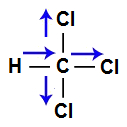
Vetores na estrutura do Triclorometano
A molécula do tetraclorometano apresenta geometria tetraédrica e quatro vetores (sendo dois horizontais e dois verticais) em direção aos átomos de cloro, por ele ser mais eletronegativo. Os dois vetores verticais são anulados por apresentar sentidos diferentes, o que ocorre com os vetores horizontais. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero.
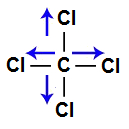
Vetores na estrutura do tetraclorometano
A molécula de amônia (NH3) apresenta geometria piramidal e três vetores (sendo dois diagonais e um vertical) em direção ao nitrogênio, por ele ser mais eletronegativo. Esses vetores diagonais devem ser obrigatoriamente decompostos (de acordo com a regra do paralelogramo), o que faz surgir um outro vetor resultante na vertical, que será somado com aquele já existente. Como a molécula apresenta apenas um vetor, o vetor momento dipolar resultante não pode ser igual a zero.
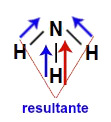
Vetores na estrutura da amônia
Letra d). A molécula de água apresenta geometria angular e dois vetores diagonais em direção ao oxigênio, por ele ser mais eletronegativo. Esses vetores diagonais devem ser obrigatoriamente decompostos (de acordo com a regra do paralelogramo), o que faz surgir o vetor resultante na vertical. Como a molécula apresenta apenas um vetor, o vetor momento dipolar resultante é diferente de zero, sendo a água uma substância com moléculas polares.
.jpg)
Vetores na estrutura da água
Na letra d temos uma molécula diatômica contendo átomos de elementos diferentes, ou seja, de diferentes eletronegatividades. Por isso, nela temos um vetor momento dipolar em direção ao cloro (que é mais eletronegativo). Como há apenas um vetor, o vetor momento dipolar dela é diferente de zero e por isso trata-se de uma molécula polar.
As outras alternativas estão incorretas porque:
a- A molécula do gás carbônico (CO2) apresenta geometria linear e dois vetores horizontais em direção aos átomos de oxigênio, por ele ser mais eletronegativo. Os dois vetores são anulados por apresentar sentidos diferentes. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero, ou seja, é apolar.
.jpg)
Vetores na estrutura do gás carbônico
b- A molécula do metano apresenta geometria tetraédrica e quatro vetores (sendo dois horizontais e dois verticais) em direção aos átomos de cloro, por ele ser mais eletronegativo. Os dois vetores verticais são anulados por apresentar sentidos diferentes, o que ocorre com os vetores horizontais. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero, ou seja, é apolar.
.jpg)
Vetores na estrutura do metano
c/e- apresentam moléculas apolares, ou seja, com momento dipolar resultante de zero por apresentarem moléculas formadas por apenas átomos de um mesmo elemento químico.
Questão: 3
Letra d). Abaixo temos a discriminação do porque apenas as moléculas I, II e IV apresentarem momento dipolar resultante igual a 0.
I- A molécula do metano (CH4) apresenta geometria tetraédrica e quatro vetores (sendo dois horizontais e dois verticais) em direção aos átomos de cloro, por ele ser mais eletronegativo. Os dois vetores verticais são anulados por apresentar sentidos diferentes, o que ocorre com os vetores horizontais. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero, ou seja, é apolar.
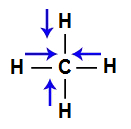
Vetores na estrutura do metano
II- A molécula do dissulfeto de carbono (CS2) apresenta geometria linear e dois vetores horizontais em direção aos átomos de enxofre, por ele ser mais eletronegativo. Os dois vetores são anulados por apresentar sentidos diferentes. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero, ou seja, é apolar.
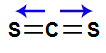
Vetores na estrutura do dissulfeto de carbono
III- a molécula apresenta dois átomos que pertencem a elementos diferentes, consequentemente possuem eletronegatividades diferentes. Logo, a molécula apresenta momento dipolar diferente, sendo polar.
IV- apresenta molécula apolar, ou seja, com momento dipolar resultante de zero por apresentar molécula formada por apenas dois átomos de um mesmo elemento químico (consequentemente com eletronegatividade diferente).
Questão: 4
Letra e). Apresentar momento dipolar permanente significa que a molécula apresenta polos, ou seja, é polar. Para isso a molécula deve apresentar momento dipolar diferente de zero. Abaixo temos a explicação da polaridade de cada uma das moléculas presentes no exercício.
1) A molécula de água apresenta geometria angular e dois vetores diagonais em direção ao oxigênio, por ele ser mais eletronegativo. Esses vetores diagonais devem ser obrigatoriamente decompostos (de acordo com a regra do paralelogramo), o que faz surgir o vetor resultante na vertical. Como a molécula apresenta apenas um vetor, o vetor momento dipolar resultante é diferente de zero, sendo a água uma substância com moléculas polares.
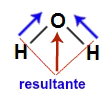
Vetores na estrutura da água
Na letra d temos uma molécula diatômica contendo átomos de elementos diferentes, ou seja, de diferentes eletronegatividades. Por isso, nela temos um vetor momento dipolar em direção ao cloro (que é mais eletronegativo). Como há apenas um vetor, o vetor momento dipolar dela é diferente de zero e por isso trata-se de uma molécula polar.
2) A molécula de amônia (NH3) apresenta geometria piramidal e três vetores (sendo dois diagonais e um vertical) em direção ao nitrogênio, por ele ser mais eletronegativo. Esses vetores diagonais devem ser obrigatoriamente decompostos (de acordo com a regra do paralelogramo), o que faz surgir um outro vetor resultante na vertical, que será somado com aquele já existente. Como a molécula apresenta apenas um vetor, o vetor momento dipolar resultante não pode ser igual a zero.
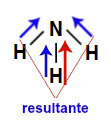
Vetores na estrutura da amônia
3) A molécula do gás carbônico (CO2) apresenta geometria linear e dois vetores horizontais em direção aos átomos de oxigênio, por ele ser mais eletronegativo. Os dois vetores são anulados por apresentar sentidos diferentes. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero, ou seja, é apolar.
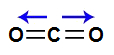
Vetores na estrutura do gás carbônico
4) A molécula do trifluoreto de boro apresenta geometria trigonal e três vetores (sendo dois diagonais para baixo e um vertical para cima) em direção ao flúor, por ele ser mais eletronegativo. Esses vetores diagonais devem ser obrigatoriamente decompostos (de acordo com a regra do paralelogramo), o que faz surgir um outro vetor resultante na vertical para baixo, anulando o vertical para cima. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero, ou seja, é apolar.
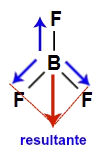
Vetores na estrutura do trifluoreto de boro
5) A molécula do dicloreto de berílio (BeCl2) apresenta geometria linear e dois vetores horizontais em direção aos átomos de cloro, por ele ser mais eletronegativo. Os dois vetores são anulados por apresentar sentidos diferentes. Como a molécula não apresenta vetor, o vetor momento dipolar resultante é igual a zero, ou seja, é apolar.
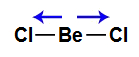
Vetores na estrutura do dicloreto de berílio
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-momento-dipolar-resultante.htm